题目内容
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列叙述正确的是( )
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |
考点:电解原理
专题:电化学专题
分析:A、电解过程中,阳极均是电解的氢氧根离子,PH变小;
B、根据阴极发生的电极反应来判断;
C、根据被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1来判断分子式;
D、根据电极反应和电子守恒知识来计算.
B、根据阴极发生的电极反应来判断;
C、根据被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1来判断分子式;
D、根据电极反应和电子守恒知识来计算.
解答:
解:A、电解过程中,两个阴极上发生电极反应:Ag++e-=Ag,Hg++e-=Hg,阳极电极反应:4OH--4e=2H2O+O2,氢氧根离子浓度变小,PH变小,故A错误;
B、在两个阳极上发生的电极反应均是氢氧根失去电子的反应,由于通电量相同,则阳极产物物质的量相等,故B错误;
C、因电解的n(硝酸银):n(硝酸亚汞)=2:1,硝酸银的化学式为AgNO3,说明1mol硝酸亚汞中含有2mol+1价的Hg,故硝酸亚汞的化学式不可能为HgNO3,只能为Hg2(NO3)2,故C正确;
D、由于电解过程中,两个阴极上发生电极反应:Ag++e-=Ag,Hg++e-=Hg,通电量相同,则生成的银和汞的物质的量相等,即得到的银和汞的物质的量之比n(银):n(汞)=1:1,故D错误.
故选C.
B、在两个阳极上发生的电极反应均是氢氧根失去电子的反应,由于通电量相同,则阳极产物物质的量相等,故B错误;
C、因电解的n(硝酸银):n(硝酸亚汞)=2:1,硝酸银的化学式为AgNO3,说明1mol硝酸亚汞中含有2mol+1价的Hg,故硝酸亚汞的化学式不可能为HgNO3,只能为Hg2(NO3)2,故C正确;
D、由于电解过程中,两个阴极上发生电极反应:Ag++e-=Ag,Hg++e-=Hg,通电量相同,则生成的银和汞的物质的量相等,即得到的银和汞的物质的量之比n(银):n(汞)=1:1,故D错误.
故选C.
点评:本题考查学生电解池的工作原理知识,注意判断阴极和阳极上发生的电极反应方程式,可以解答,难度中等.

练习册系列答案
相关题目
除去下列物质中的少量的杂质,所用试剂和方法不正确的是( )
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | CO2 | CO | 在氧气中点燃 |
| B | NaCl固体 | 泥沙 | 加水溶解、过滤、蒸发结晶 |
| C | Cu | Fe | 加稀盐酸溶解、过滤 |
| D | KCl | I2 | 加热 |
| A、A | B、B | C、C | D、D |
在密闭容器中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,C的浓度为原平衡的1.6倍,下列叙述正确的是( )
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的质量分数变大 |
| D、a<c+d |
下列有关叙述正确的是( )
| A、任何晶体中,若含有阳离子也一定含有阴离子 |
| B、金属键越强,则该金属的金属性越强 |
| C、金属钨的熔点高于金属钠,是因为钨的金属键更强 |
| D、金属导电的过程实质上就是金属键被破坏的过程,不能用“电子气理论”来解释 |
下列物质中属于天然高分子化合物的是( )
| A、淀粉 | B、葡萄糖 | C、油脂 | D、乙酸 |

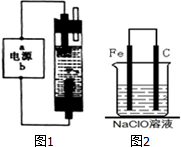 电化学与生产生活密切相关.请运用相关知识回答下列问题:
电化学与生产生活密切相关.请运用相关知识回答下列问题: