题目内容
T℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示.则下列结论正确的是( )
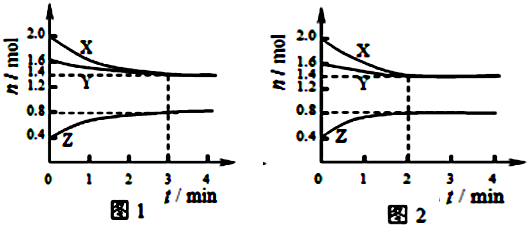

| A、容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B、反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L?min) |
| C、若改变反应条件,使反应进程如图2所示,则改变的条件是增大压强 |
| D、如图1所示,该反应达到化学平衡时,X的转化率为70% |
考点:化学平衡的影响因素,化学平衡建立的过程
专题:化学平衡专题
分析:A.根据图示1可知:X、Y是反应物,Z是生成物,它们的物质的量的比等于3:2:1,由于最终各种物质都存在,所以该反应是可逆反应.故容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g);
B.根据v=
计算出反应进行前3min内,用X表示的反应速率v(X);
C.图3与图1相比,平衡时各组分的物质的量不变,到达平衡时间缩短,说明改变条件,增大反应速率,平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是增大压强,故改变条件是使用催化剂;
D.由图2可知,温度T2到达平衡需要的时间较短,故T2>T1,温度越高Y的含量降低,升高温度平衡向正反应方向移动.
B.根据v=
| △c |
| △t |
C.图3与图1相比,平衡时各组分的物质的量不变,到达平衡时间缩短,说明改变条件,增大反应速率,平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,不可能是增大压强,故改变条件是使用催化剂;
D.由图2可知,温度T2到达平衡需要的时间较短,故T2>T1,温度越高Y的含量降低,升高温度平衡向正反应方向移动.
解答:
解:A.由图1知,X的物质的量减少量为:(2.0-1.4)mol=0.6mol,Y的物质的量减少量为:(1.6-1.4)mol=0.2mol,X、Y为反应物;Z的物质的量增加量为:(0.8-0.4)mol=0.4mol,Z为生成物,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,所以反应可表示为:3X(g)+Y(g)?2Z(g),故A正确;
B.反应进行前3min内,用X表示的反应速率为:v(X)=
=0.1mol/(L?min),故B正确;
C.由图2可知:各种物质在2min时就达到了平衡,但是物质的平衡浓度不变,所以平衡未发生移动;因为该反应是反应前后气体体积不等的可逆反应,则改变的条件是使用催化剂,故C错误;
D.X的转化率=
×=30%,故D错误;
故选AB.
B.反应进行前3min内,用X表示的反应速率为:v(X)=
| ||
| 3min |
C.由图2可知:各种物质在2min时就达到了平衡,但是物质的平衡浓度不变,所以平衡未发生移动;因为该反应是反应前后气体体积不等的可逆反应,则改变的条件是使用催化剂,故C错误;
D.X的转化率=
| (2.0-1.4)mol/L |
| 2.0mol/L |
故选AB.
点评:本题考查了化学平衡的图象及化学反应速率的计算、化学平衡的影响、平衡移动原理等,题目难度中等,根据图象正确分析曲线变化特点是解答本题的关键,结合平衡移动原理进行解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:下列推断合理的是( )


| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |
除去下列物质中的少量的杂质,所用试剂和方法不正确的是( )
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | CO2 | CO | 在氧气中点燃 |
| B | NaCl固体 | 泥沙 | 加水溶解、过滤、蒸发结晶 |
| C | Cu | Fe | 加稀盐酸溶解、过滤 |
| D | KCl | I2 | 加热 |
| A、A | B、B | C、C | D、D |
下列图示与对应叙述相符合的是( )
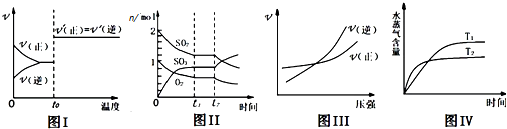

| A、图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B、图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C、图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D、图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
外围电子排布为4d105s1的元素在周期表中应位于( )
| A、第4周期ⅠB族 |
| B、第5周期ⅠB族 |
| C、第5周期ⅡB族 |
| D、第5周期ⅢB族 |
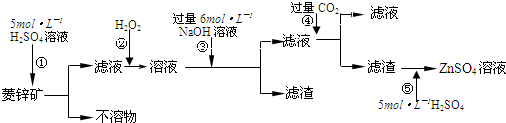
 (1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择
(1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择