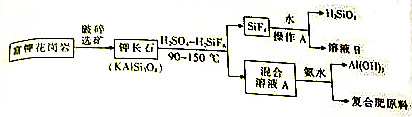
题目内容
18.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )| A. | 常温常压下,27g Al3+中含有的电子数目为13 NA | |
| B. | 22.4 L氧气中一定含有2NA个氧原子 | |
| C. | 23gNa和足量的O2完全燃烧条件下转移电子数为NA | |
| D. | 标准状况下,22.4 L乙醇(CH3CH2OH)中含有的氧原子数为NA |
分析 A.1molAl3+中含有10mol电子;
B.气体存在的条件未知,不能确定气体的物质的量;
C.23gNa的物质的量为1mol,完全反应失去电子数为NA;
D.标准状况下乙醇为液体,题中条件无法计算乙醇的物质的量.
解答 解:A.27g Al3+的物质的量为1mol,含有的电子数目为10NA,故A错误;
B.由于气体存在的条件不能确定是否标准状况下,则22.4L氧气不一定为1mol,无法确定原子数目,故B错误;
C.23gNa的物质的量为1mol,完全反应失去电子数为NA,即转移电子数为NA,故C正确;
D.在标况下,乙醇不是气体,不能使用标况下的气体摩尔体积计算乙醇的物质的量,故D错误.
故选C.
点评 本题考查阿伏加德罗常数,题目难度不大,本题注意物质存在的条件以及分子的构成,为该题考查的侧重点,也是易错点,答题时注意把握.

练习册系列答案
相关题目
8.有四瓶常用溶液:①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液.不用其他试剂,可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序可能是( )
| A. | ④①③② | B. | ①③④② | C. | ①④③② | D. | ①④②③ |
13.为了检验某FeCl2溶液是否变质,应选用的试剂是( )
| A. | 稀盐酸 | B. | KSCN溶液 | C. | 铁粉 | D. | 石蕊试液 |
3.标准状况下,10gCO和CO2混合气体的体积是6.72L,则此混合气体中,CO和CO2的物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 4:3 | D. | 2:3 |
10.下列方程式书写正确的是( )
| A. | H2CO3的电离方程式H2CO3?2H++CO32- | |
| B. | HCO3-在水溶液中的电离方程式:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的电离方程式:NaOH?Na++OH- | |
| D. | CaCO3的电离方程式:CaCO3?Ca2++CO32- |
8.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如图:
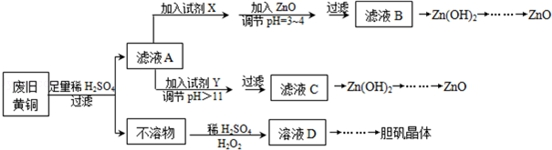
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)试剂X可能是H2O2,其作用是将Fe2+氧化为Fe3+.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为97.00%.
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会偏高(填“偏高”、“偏低”或“不变”).

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)试剂X可能是H2O2,其作用是将Fe2+氧化为Fe3+.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-
①胆矾晶体的纯度为97.00%.
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会偏高(填“偏高”、“偏低”或“不变”).