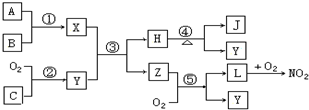
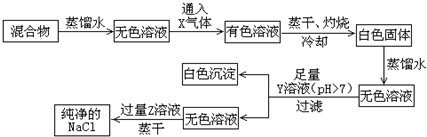
题目内容
8.在一定温度下,电解某K2SO4饱和溶液,当阳极产生a mol气体时,溶液析出W g晶体(不含结晶水),则剩余溶液的质量分数为( )| A. | $\frac{100W}{36a}$×100% | B. | $\frac{W}{36a+W}$×100% | C. | $\frac{W}{3600a+W}$×100% | D. | $\frac{100W}{36a+W}$×100% |
分析 电解饱和K2SO4溶液时,本质是电解水,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中K2SO4过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的K2SO4晶体和电解的水组成的也是饱和溶液,根据质量分数公式计算即可.
解答 解:电解饱和K2SO4溶液时,本质是电解水,发生反应2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,电解水后,溶液中K2SO4过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的K2SO4晶体和电解的水组成的也是饱和溶液,阳极产生的气体是氧气,
设电解水的质量为x:
2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑
36g 1
x amol
解得:x=36ag,
所以饱和溶液的质量分数为$\frac{Wg}{36ag+Wg}$×100%=$\frac{W}{36a+W}$×100%,
故选B.
点评 本题以电解原理为载体考查了质量分数的计算,难度较大.明确电解后析出的K2SO4晶体和电解的水组成的是饱和溶液是解本题的关键.

练习册系列答案
相关题目
19.下列选项中,离子方程式书写正确的是( )
| A. | 向NaA1O2溶液中通入过量CO2:2A1O2-+CO2+3H2O═2Al (OH)3↓+CO32- | |
| B. | 钠与氢氧化钠溶液反应:2Na+2H2O═2Na++H2↑+2OH- | |
| C. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- | |
| D. | 向氯化铁溶液中插入铜片:2Fe3++Cu═2Fe+Cu2+ |
16.3He可以作为核聚变材料,以下关于3He的说法正确的是( )
| A. | 比4He少一个质子 | B. | 比4He多一个中子 | ||
| C. | 是4He的同素异形体 | D. | 是4He的同位素 |
17.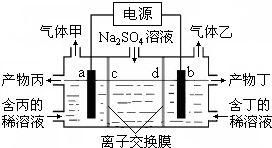 工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )
 工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法中正确的是( )| A. | a极与电源的负极相连 | B. | 产物丙为硫酸溶液 | ||
| C. | 离子交换膜d为阴离子交换膜 | D. | b电极反应式:4OH--4e-=O2↑+2H2O |
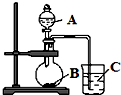 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.