题目内容
16.从海水中提取一些重要的化工产品的工艺流程如图所示.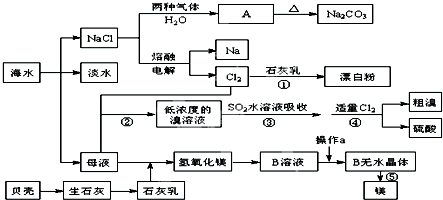
根据上述流程图回答下列问题:
(1)图中A的化学式为NaHCO3,在制取A的过程中需向饱和NaCl溶液中先后通入两种气体,后通入气体的化学式为CO2.
(2)海水淡化处理的方法有蒸馏法、冷冻法、离子交换膜法.(写出3种即可)
(3)过程⑤的化学方程式为MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)从B溶液制备B的无水晶体的“操作a”为将MgCl2溶液在HCl气流中蒸干.
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,写出反应的离子方程式SO2+Br2+2H2O=4H++SO42-+2Br-.
(6)过程②到过程④的变化为“Br-→Br2→Br-→Br2”,其目的是富集溴.
分析 根据上述流程图分析,海水通过海水晒盐、海水淡化得到氯化钠、母液,氯化钠溶液中通入氨气、二氧化碳发生反应生成碳酸氢钠晶体A和氯化铵,碳酸氢钠晶体受热分解生成碳酸钠、二氧化碳和水,得到固体氯化钠通过电解熔融氯化钠得到氯气和钠,氯气通入石灰乳反应生成氯化钙、次氯酸钙和水得到漂白粉,氯气通入母液氧化溴离子生成低浓度的溴单质溶液,用二氧化硫吸收生成溴离子,再通过通入氯气氧化溴离子生成溴单质,过程中富集溴,得到粗溴和硫酸,贝壳分解生成生石灰溶于水得到石灰乳,加入母液沉淀镁离子生成氢氧化镁沉淀,过滤后加入盐酸溶解氢氧化镁得到B溶液,通过再氯化氢气流中蒸发氯化镁溶液得到氯化镁晶体失水得到固体氯化镁,电解熔融氯化镁生成镁和氯气,
(1)由A受热分解生成Na2CO3知,A的化学式为NaHCO3,生成A的方法是侯氏制碱法,在制取A的过程中需向饱和NaCl溶液中先通入NH3,后通入气体的化学式为CO2,因为NH3极易溶于水,而CO2能溶于水,先通入氨气可吸收更多的CO2,才能生成NaHCO3;
(2)海水淡化处理的方法有 蒸馏法、冷冻法、离子交换膜法;
(3)过程⑤应为电解熔融的无水MgCl2制取Mg;
(4)从MgCl2溶液制备无水MgCl2晶体,目的是除水,但又要抑制Mg2+水解,故操作a”为 将MgCl2 溶液在HCl气流中蒸干;
(5)过程③为SO2与溴水反应,反应生成硫酸和HBr;
(6)过程②到过程④的变化为Br-→Br2→Br-→Br2,其目的是增大溴的浓度,实现溴的富集.
解答 解:(1)由A受热分解生成Na2CO3知,A的化学式为 NaHCO3,生成A的方法是侯氏制碱法.因为NH3极易溶于水,而CO2能溶于水,先通入氨气可吸收更多的CO2,这样才能生成NaHCO3,所以在制取NaHCO3的过程中需向饱和NaCl溶液中先通入NH3,后通入CO2,
故答案为:NaHCO3;CO2;
(2)海水淡化处理的方法有蒸馏法、冷冻法、离子交换膜法等,故答案为:蒸馏法、冷冻法、离子交换膜法;
(3)过程⑤应为电解熔融的无水MgCl2制取Mg,故化学方程式为MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)从MgCl2溶液制备无水MgCl2晶体,目的是除水,但又要抑制Mg2+水解,故操作a”是将MgCl2溶液在HCl气流中蒸干,
故答案为:将MgCl2溶液在HCl气流中蒸干;
(5)过程③用SO2水溶液吸收溴单质,吸收率可达93%,生成两种强酸,离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;
(6)过程②得到的是的溶液溴的浓度太低,所以过程②到过程④的变化为Br-→Br2→Br-→Br2,其目的是增大溴的浓度,实现溴的富集,
故答案为:富集溴.
点评 本题考查了海水的综合利用,包括海水提镁、提溴、淡化等,化学方程式、离子方程式的书写等知识,综合性较强,题目难度中等.

 53随堂测系列答案
53随堂测系列答案| A. | 次氯酸的电子式为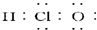 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
| A. | $\frac{b}{2}$ g | B. | 2b g | C. | $\frac{3}{4}$a g | D. | $\frac{3}{4}$b g |
| A. | 1 mol甲醇中含有C-H键的数目为4NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol丙烯酸中含有双键的数目为NA |
| A. | 常温下铝在浓硫酸中钝化 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分金属的熔点都低 | |
| D. | 工业上常利用铝热反应冶炼难熔的金属 |
| A. | 丙烷的比例模型是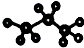 | |
| B. | C2H4与C3H6一定互为同系物 | |
| C. | 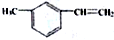 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为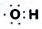 ,1mol-OH含有7mol电子 ,1mol-OH含有7mol电子 |
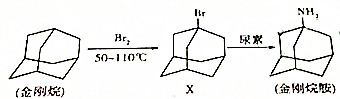
| A. | 金刚烷是不饱和烃 | B. | 金刚烷胺的分子式为C10H16N | ||
| C. | 上述反应都属于取代反应 | D. | X与尿素反应的另-种生成物是H2O |