题目内容
17.(1)工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制备工业盐酸,流程复杂且造成能量浪费,有人设想利用原电池原理直接制备盐酸的同时还能获取电量.①装置:两极材料都用石墨,一极通H2,一极通Cl2,电解质溶液最好选用b(填选项字母).
a.蒸馏水 b.盐酸 c.氢氧化钠溶液
②原理:电池反应式为H2+Cl2=2HCl;通氢气的一极发生氧化(填“氧化”或“还原”)反应.
(2)用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;催化剂\;}}{400℃}$2Cl2+2H2O,
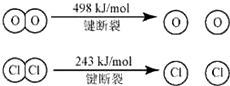
已知,反应A中,4molHCl被氧化,放出115.6kJ,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.断开1molH-O键与断开1molH-Cl键所需能量相差约为31.9kJ,可推之H2O中H-O比HCl中H-Cl键强(填“强”或“弱”).
分析 (1)通入氢气的一极为负极,通氯气的一极为正极,根据电极反应式知,电解质溶液最好选用稀盐酸;
(2)反应A中,4mol HCl被氧化,放出115.6kJ的热量,依据热化学方程式书写方法,标注物质聚集状态和对应焓变写出;
依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,焓变=反应物断键吸收热量-生成物形成化学键放出热量计算.
解答 解:(1)①通入氢气的一极为负极,通氯气的一极为正极,根据电极反应式知,电解质溶液最好选用稀盐酸,
故答案为:b;
②通入氢气的一极失去电子发生氧化反应,为负极,通氯气的一极为正极,总反应为H2+Cl2=2HCl,
故答案为:H2+Cl2=2HCl;氧化;
(2)依据反应A中,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;
焓变=反应物断键吸收热量-生成物形成化学键放出热量,4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol,4×E(H-Cl)+498-[243×2+4×E(H-O)]=-115.6,得到4×E(H-O)-4×E(H-Cl)=498-486+115.6=127.6,E(H-O)-E(H-Cl)=31.9,H2O中H-O键比HCl中H-Cl键强,
故答案为:4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol;31.9;强.
点评 本题考查了原电池的原理、热化学方程式书写,化学键键能和焓变关系计算,考查了学生综合运用知识解决问题的能力,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
8.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 将煤通过物理变化气化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| C. | 在某爆炸事故救援现场,消防员发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
5.下列实验装置或操作能达到实验目的是( )
| A. |  实验室制硝基苯 | B. |  检查装置气密性 | ||
| C. |  利用排空气法收集丙烷 | D. |  石油分馏 |
12. 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
2.下列原理或操作的说法正确的是( )
| A. | 吸滤既能加快过滤速率和得到更干燥的沉淀,又能使沉淀颗粒变粗变大 | |
| B. | 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用酒精洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率 | |
| C. | 记录Na2S2O3与稀硫酸的反应时间,应从溶液混合时开始计时,到刚出现浑浊结束 | |
| D. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤而不要用水洗涤主要是为了减少晶体损失 |
7. 美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
 美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )
美国魏考克斯合成的一种有机分子,像一尊释迦牟尼佛.称为释迦牟尼分子.有关该有机分子的说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 1mol该有机物完全燃烧需消耗25molO2 | |
| C. | 1mol该有机物最多可以和10molH2发生加成反应 | |
| D. | 该有机物的一氯代产物的同分异构体有12种 |

