题目内容
11.从Cl、H、O、Na 四种元素中,选择适当的元素,写成符合如表要求的化合物的化学式.| 盐 | 碱 | 酸 | 单质 | 氧化物 | |
| 化学式 |
分析 首先要熟记常见元素与常见原子团的化合价以及化合价的规律和原则,弄清化合价数值交叉法书写化学式(即将正、负化合价的数值交叉到相应符号的右下角,但注意原子团看作一体,含约数的一般要约分),
盐是金属阳离子和酸根阴离子构成的化合物为盐.水溶液中电离出的阴离子全部是氢氧根离子的化合物为碱,水溶液中电离出的阳离子全部是氢离子的化合物为酸,一种元素组成的纯净物为单质,两种元素组成其中一种为氧元素的化合物为氧化物.
解答 解:由单质、氧化物、酸、碱、盐的概念,根据化合价的原则(在化合物中正、负化合价的代数和为零),检验化学式的书写是否正确.
盐为:NaCl;
碱为:NaOH;
酸为:HCl;
单质为:H2或Cl2、O2、Na,
氧化物为:H2O或H2O2、Na2O;
故答案为:
| 盐 | 碱 | 酸 | 单质 | 氧化物 | |
| 化学式 | NaCl | NaOH | HCl | H2或Cl2、O2、Na | H2O或H2O2、Na2O |
点评 本题既考查了常见元素与常见原子团的化合价以及化合价的规律和原则,还考查了化学式的书写方法和技巧,注意掌握酸、碱、盐、氧化物概念实质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
1.设NA代表阿伏伽德罗常数,下列说法正确的是( )
①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
2.下列各组化合物中,化学键的类型相同的是( )
| A. | CO2和NaCl | B. | Na2O和Na2O2 | C. | CaCl2和Na2S | D. | HCl和NaOH |
19.下列关于常见有机化合物的说法中正确的是( )
| A. | 乙烷和Cl2在光照条件下反应生成6种氯代产物 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
6.下列属于放热反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,下列有关叙述正确的是( )
| A. | B、D的最高价氧化物中,B、D与氧原子都形成离子键 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | D元素位于元素周期表中的第三周期第ⅣA族 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
20.如图有关实验原理、操作或现象不正确的是( )
| A. |  可制得金属锰,用同样的装置可制得金属铬 | |
| B. |  制取少量氨气 | |
| C. |  除去Cl2中的少量HCl | |
| D. |  制乙酸乙酯 |
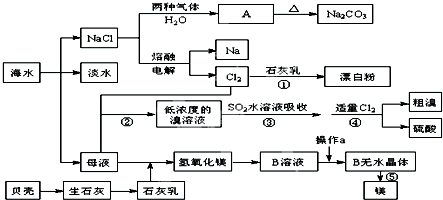
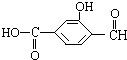 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如图具有三个官能团:-COOH、酚-OH和-CHO,所以这个化合物可看作羧酸类,酚类和醛类.