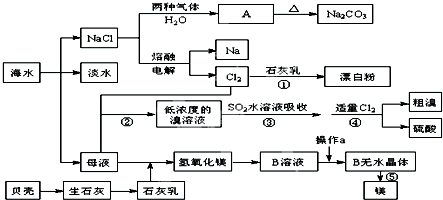
题目内容
6.下列有关叙述中,正确的是( )| A. | 次氯酸的电子式为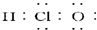 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
分析 A.次氯酸为共价化合物,氯原子和氧原子都达到8电子稳定结构;
B.氯气和水反应生成盐酸和次氯酸,盐酸和碳酸氢钠也会发生反应;
C.氯化铜溶液加热促进水解得到水解产物氢氧化铜;
D.氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性.
解答 解:A.次氯酸的电子式中O和Cl要符合8电子结构,其电子式为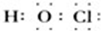 ,故A错误;
,故A错误;
B.氯气和水反应生成盐酸和次氯酸,盐酸和碳酸氢钠也会发生反应,将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl同时也会和碳酸氢钠反应,故B错误;
C.氯化铜溶液加热促进水解,水解生成的HCl受热挥发,最后氯化铜完全水解得到Cu(OH)2,Cu(OH)2受热分解生成CuO,故C错误;
D.氯气可以使湿润的有色布条褪色,是因为Cl2+H2O=HClO+HCl,次氯酸具有漂白作用,氯气无漂白性,故D正确;
故选D.
点评 本题考查了电子式的书写、物质除杂判断、物质漂白性、盐类水解等知识,题目难度中等,试题涉及的内容较多,充分考查了学生对基础知识的掌握情况.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列有关化学键的叙述,正确是的( )
| A. | 共价化合物中可以含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物可能是共价化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
14.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应,放出大量气体,反应过程表示如下:
①H2O2+2KI+H2SO4═I2+K2SO4+2H2O;
②H2O2+I2═2HIO;
③H2O2+2HIO═I2+O2↑+2H2O.
下列有关该反应的说法正确的是( )
①H2O2+2KI+H2SO4═I2+K2SO4+2H2O;
②H2O2+I2═2HIO;
③H2O2+2HIO═I2+O2↑+2H2O.
下列有关该反应的说法正确的是( )
| A. | 反应速率与SO42-浓度有关 | |
| B. | 催化剂能加快化学反应速率,但反应物所需活化能不变 | |
| C. | 碘单质是过氧化氢分解的催化剂 | |
| D. | 与一定量H2O2反应的KI溶液浓度越大,反应速率越慢 |
1.设NA代表阿伏伽德罗常数,下列说法正确的是( )
①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
18.下列关于化学反应速率的叙述不正确的是( )
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 工业合成中使用适当的催化剂为了加快反应速率 | |
| D. | 实验室用锌和稀硫酸制取H2时,常滴加少量硫酸铜溶液加快反应的速率 |
 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦
;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦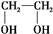 ;⑧CH3CH2OH
;⑧CH3CH2OH 某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.