题目内容
10.利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:
已知:Ksp[Zn(OH)2]=1.2×10-17;Zn(OH)2既能溶于强酸,又能溶于强碱.还能溶于氨水,生成[Zn(NH3)4]2+.
(1)溶液A中加稀H2SO4生成Zn(OH)2的离子方程式为ZnO22-+2H+=Zn(OH)2↓.
(2)常温下,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,若溶液A中加入稀H2SO4过量,会溶解产生的Zn(OH)2,Zn(OH)2开始溶解的pH为8.3,为防止Zn(OH)2溶解,可将稀H2SO4改为CO2.(lg2=0.3)
(3)“部分氧化”阶段,NaClO3被还原为Cl-,还原剂与氧化剂反应的物质的量之比是6:1.
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是防止Fe2+[或Fe(OH)2]被空气(或氧气)氧化.
②Fe3O4胶体粒子的直径的范围是1~100nm.
③确定滤液B中含有Fe2+的试剂是K3[Fe(CN)6]溶液或酸性高锰酸钾溶液.
(5)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制.
分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A加稀硫酸使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过过滤、洗涤、干燥,灼烧得到ZnO,
不溶物Fe中加入稀盐酸,反应生成氯化亚铁,加入适量NaClO3,氧化部分亚铁离子为铁离子:流程中加人NaClO3氧化部分亚铁离子为铁离子,发生反应为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,得到含Fe2+、Fe3+的B溶液,再加入NaHCO3,并通入氮气,生成四氧化三铁胶体粒子,据此分析解答.
解答 解:(1)溶液A为Na2ZnO2,加稀H2SO4生成Zn(OH)2,离子方程式为ZnO22-+2H+=Zn(OH)2↓;
故答案为:ZnO22-+2H+=Zn(OH)2↓;
(2)已知:Ksp[Zn(OH)2]=1.2×10-17,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,Zn(OH)2开始溶解,则c(Zn2+)•c(OH-)2<Ksp[Zn(OH)2],则c(OH-)<$\sqrt{\frac{1.2×1{0}^{-17}}{3×1{0}^{-6}}}$=2×10-6mol/L,故c(H+)>5×10-9mol/L,故pH为8.3时开始溶解,为防止Zn(OH)2溶解,可将稀H2SO4改为弱酸,故可选择通入CO2气体;
故答案为:8.3;CO2;
(3)流程中加人NaClO3氧化部分亚铁离子为铁离子,发生反应为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,还原剂与氧化剂反应的物质的量之比是6:1;
故答案为:6:1;
(4)①持续通入N2,防止Fe2+[或Fe(OH)2]被氧化;
故答案为:防止Fe2+[或Fe(OH)2]被空气(或氧气)氧化;
②胶体微粒直径范围为1~100nm;
故答案为:1~100nm;
③亚铁离子能与K3[Fe(CN)6]溶液生成蓝色沉淀,同时具有还原性,可使酸性高锰酸钾溶液褪色;
故答案为:K3[Fe(CN)6]溶液或酸性高锰酸钾溶液;
(5)根据题意:Zn(OH)2既能溶于强酸,又能溶于强碱,还能溶于氨水,生成[Zn(NH3)4]2+,则可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制;
故答案为:可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制.
点评 本题以物质的制备为载体,考查实验基本操作和技能,对信息的利用、实验条件的控制、溶度积的计算等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力,注意对题目信息的获取.

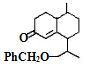
| A. | 属于芳香烃 | B. | 是高分子化合物 | ||
| C. | 可使溴水和酸性高锰酸钾溶液褪色 | D. | 苯环上的一氯取代物有5种 |
 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:I. 向软锰矿浆中通入SO2,锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2,充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.
【资料】部分阳离子形成氢氧化物沉淀的pH
| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(2)II 中加入MnO2的主要目的是将Fe2+氧化为Fe3+;调溶液 pH=4.7,生成的沉淀主要含有Fe(OH)3、Al(OH)3
和少量CaSO4.
(3)III中加入阳离子吸附剂,主要除去的离子是Ca2+、Pb2+.
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2.
①电解MnSO4溶液的离子方程式是Mn2++2H2O$\frac{\underline{\;通电\;}}{\;}$MnO2+H2↑+2H+.
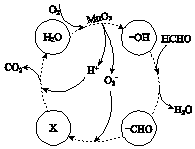
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是HCO3-,总反应的化学方程式是HCHO+O2$\frac{\underline{\;MnO_{2}\;}}{\;}$CO2+H2O.
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
| A. | 熟石灰和水 | B. | 生石灰和水 | ||
| C. | 氯化钠和水 | D. | 氯化铵和氢氧化钡晶体 |