题目内容
3.设NA代表阿伏加德罗常数,下列说法不正确的是( )| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 1 mol/L的CH3COOH中CH3COO-的浓度小于1 mol/L,而1 mol/L CH3COONa中CH3COO-等于1 mol/L | |
| D. | 18g 18O2中含有的中子数为10NA |
分析 A.二氧化氮与水反应为歧化反应;
B.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算;
C.醋酸为弱酸部分电离,醋酸根离子为弱酸根离子,水溶液中部分水解;
D.质量转化为物质的量,结合1个18O2中含有20个中子.
解答 解:A.反应3NO2+H2O═2HNO3+NO转移的电子为2mol,即3mol的NO2反应,转移2mol电子,则1.5mol二氧化氮反应转移1mol电子,转移的电子数为NA,故A正确;
B.常温常压下,0.5NA个CO2分子质量为$\frac{0.5N{\;}_{A}}{N{\;}_{A}}$×44g/mol=22 g,故B正确;
C.醋酸根离子为弱酸根离子,水溶液中部分水解,所以1 mol/L CH3COONa中CH3COO-小于1 mol/L,故C错误;
D.18g 18O2中含有的中子数为$\frac{18g}{36g/mol}$×20×NA=10NA,故D正确;
故选:C.
点评 本题考查物质的量的计算以及阿伏加德罗常数,题目难度不大,注意相关物质的量的计算公式的运用,注意弱电解质电离特点.

练习册系列答案
相关题目
13.下列关于溶液的配制说法不正确的是( )
| A. | 将质量分数为98%的浓硫酸稀释成质量分数为20%的稀硫酸要用容量瓶配制 | |
| B. | 配制100mL1mol/L的氢氧化钠溶液,称量固体质量为4.0g | |
| C. | 容量瓶在定容时,若视线仰视,会使得配制出的溶液物质的量浓度偏小 | |
| D. | 容量瓶洗涤时,若瓶底上有少量蒸馏水,可不必烘干直接使用 |
10.下列叙述正确的是( )
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| B. | 在溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀,证明原溶液中有Fe2+ | |
| C. | 向FeCl3溶液中滴加稀氨水,可制备Fe(OH)3胶体 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发、灼烧}{→}$无水FeCl3 |
8.下列说法正确的是( )
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| C. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
15.下列说法中不正确的是( )
①高分子化合物不溶于任何溶剂
②高分子化合物对环境都会产生污染
③天然高分子材料主要成分都是纤维素
④塑料均有热塑性
⑤许多合成高分子材料在性能上优于天然高分子材料.
①高分子化合物不溶于任何溶剂
②高分子化合物对环境都会产生污染
③天然高分子材料主要成分都是纤维素
④塑料均有热塑性
⑤许多合成高分子材料在性能上优于天然高分子材料.
| A. | ①③④⑤ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
12.如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O
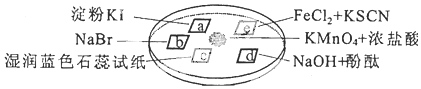
对实验现象的“解释或结论”正确的是( )
已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |
| A. | A | B. | B | C. | C | D. | D |
13.在实验室里,要想使AlCl3溶液中的 Al的全部沉淀出来,应选用下列试剂中.( )
| A. | 石灰水 | B. | NaOH 溶液 | C. | 硫酸 | D. | 氨水 |
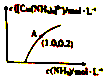 元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题:
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题: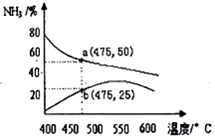 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.