题目内容
15.方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)是提炼铅及其化合物的重要矿物,其工艺流程如图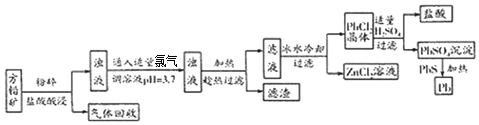
回答下列问题:
(1)流程中“趁热”过滤的原因是防止PbCl2结晶析出,滤渣的主要成分是Ag和Fe(OH)3.
(2)该工艺流程中可循环利用的物质是盐酸.
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为PbSO4+PbS$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+SO2.
(4)《药性论》中有关铅丹(Pb3O4)的描述是:“治惊悸狂走,呕逆,消渴.”将PbO高温焙烧可制得铅丹,铅丹中含有的PbO与Al2O3性质相似,可用氢氧化钠溶液提纯铅丹,提纯时发生反应的离子方程是PbO+OH-+H2O=[Pb(OH)3]-.
(5)以石墨为电极,电解Pb(NO3)2溶液制备PbO2,电解过程中阳极的电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时(忽略副反应),理论上蓄电池负极增重9.6g.
(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中$\frac{c(P{b}^{2+})}{c(C{u}^{2+})}$=2.6×108.(已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36)
分析 方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag),粉碎加盐酸,其中PbS、ZnS与盐酸反应生成氯化铅、氯化锌和硫化氢气体,铁与盐酸反应生成氯化亚铁和氢气,Ag不反应,将氢气和硫化氢气体回收,向浊液中通入足量的氯气氧化亚铁离子,并调节溶液的pH,沉淀铁离子,为防止PbCl2结晶析出,趁热过滤,将Ag和Fe(OH)3与氯化铅和氯化锌分离,则滤渣为Ag和Fe(OH)3,冰水冷却滤液,PbCl2结晶析出,过滤,得到PbCl2晶体,向晶体加入适量的硫酸,生成硫酸铅沉淀,过滤,将硫酸铅沉淀与硫化铅加热反应制得铅,PbSO4+PbS$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+SO2,据此分析解答(1)~(3);
(4)PbO与Al2O3性质相似,与氢氧化钠反应的离子方程式为:PbO+OH-+H2O=[Pb(OH)3]-;
(5)电解时,阳极上铅离子失电子和水反应生成二氧化铅;根据电路路电子转移数目相等计算;
(6)根据$\frac{c(P{b}^{2+})}{c(C{u}^{2+})}$=$\frac{c(P{b}^{2+})•c({S}^{2-})}{c(C{u}^{2+})•c({S}^{2-})}$=$\frac{Ksp(PbS)}{Ksp(CuS)}$计算.
解答 解:(1)由分析可知,为防止PbCl2结晶析出,趁热过滤;滤渣为Ag和Fe(OH)3;
故答案为:防止PbCl2结晶析出;Ag和Fe(OH)3;
(2)流程中,反应消耗盐酸,向PbCl2晶体加入适量的硫酸又生成盐酸,可循环利用;
故答案为:盐酸;
(3)PbSO4与PbS在加热条件下发生反应的化学方程式为:PbSO4+PbS$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+SO2;
故答案为:PbSO4+PbS$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+SO2;
(4)PbO与Al2O3性质相似,与氢氧化钠反应的离子方程式为:PbO+OH-+H2O=[Pb(OH)3]-;
故答案为:PbO+OH-+H2O=[Pb(OH)3]-;
(5)电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O-2e-=PbO2↓+4H+;若电解过程中以铅蓄电池为电源,当电解装置中阳极增重23.9g时,说明阳极生成PbO2的质量为23.9g,则n(PbO2)=23.9g÷239g/mol=0.1mol,故转移电子为0.2mol,蓄电池的负极为Pb-2e-+SO42-=PbSO4,转移电子数为0.2mol,故负极增重为0.1mol×303g/mol-0.1×207g/mol=9.6g;
故答案为:Pb2++2H2O-2e-=PbO2↓+4H+;9.6;
(6)已知KSP(PbS)=3.4×10-28,Ksp(CuS)=1.3×10-36,取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中$\frac{c(P{b}^{2+})}{c(C{u}^{2+})}$=$\frac{c(P{b}^{2+})•c({S}^{2-})}{c(C{u}^{2+})•c({S}^{2-})}$=$\frac{Ksp(PbS)}{Ksp(CuS)}$=$\frac{3.4×1{0}^{-28}}{1.3×1{0}^{-36}}$=2.6×108;
故答案为:2.6×108.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、电化学的计算、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
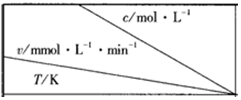 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |

| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 | |
| B. | 铜导线替换盐桥,原电池仍继续工作 | |
| C. | 开始时,银片上发生的反应是Ag-e-═Ag+ | |
| D. | 电子通过盐桥从乙池流向甲池 |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,溶液呈血红色 | |
| B. | 在溶液中加入K3[Fe(CN)6]溶液,生成蓝色沉淀,证明原溶液中有Fe2+ | |
| C. | 向FeCl3溶液中滴加稀氨水,可制备Fe(OH)3胶体 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发、灼烧}{→}$无水FeCl3 |
| A. | 2Na2O2+2N2O5═4NaNO3+O2↑ | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O4═2NaNO3 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2↑ |
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| C. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
| A. | KW/C(OH-)=10-12mol•L-1的溶液中:Na+、K+、SiO32-、Cl- | |
| B. | 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| C. | 由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液中:Na+、CO32-、SO32-、Cl- | |
| D. | 使KSCN显红色的溶液中:NH4+、K+、Cl-、A1O2- |
| A. | 在标准状况下,1molH2O所占体积约为22.4L | |
| B. | OH-所含电子数是10 | |
| C. | 0.5molH2和0.5molN2体积相同 | |
| D. | 从1L 0.5mol•L-1NaCl溶液中取出200mL溶液,其物质的量浓度为0.1mol•L-1 |