题目内容
下列关于叙述正确的是( )
| A、物质的量是含有一定数目粒子的集合体 |
| B、摩尔质量就是该物质的相对分子质量或相对原子质量 |
| C、单位物质的量的物质所占的体积就是气体摩尔体积 |
| D、40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L |
考点:摩尔质量,气体摩尔体积,物质的量浓度
专题:化学用语专题
分析:A、物质的量是表示微观粒子集合体的物理量;
B、摩尔质量数值上等于该物质的相对分子质量或相对原子质量;
C、一定温度压强条件下,单位物质的量的气体所占的体积就是气体摩尔体积;
D、依据n=
计算物质的量,溶解在1L水中溶液体积大于1L.
B、摩尔质量数值上等于该物质的相对分子质量或相对原子质量;
C、一定温度压强条件下,单位物质的量的气体所占的体积就是气体摩尔体积;
D、依据n=
| m |
| M |
解答:
解:A、物质的量是表示微观粒子集合体的物理量,物质的量是含有一定数目粒子的集合体,故A正确;
B、摩尔质量数值上等于该物质的相对分子质量或相对原子质量单位不同,故B错误;
C、一定温度压强条件下,单位物质的量的气体所占的体积就是气体摩尔体积,固体液体不存在其他摩尔体积,故C错误;
D、依据n=
计算物质的量=
=1mol,溶解在1L水中溶液体积大于1L,溶液溶质的物质的量浓度小于1mol/L,故D错误;
故选A.
B、摩尔质量数值上等于该物质的相对分子质量或相对原子质量单位不同,故B错误;
C、一定温度压强条件下,单位物质的量的气体所占的体积就是气体摩尔体积,固体液体不存在其他摩尔体积,故C错误;
D、依据n=
| m |
| M |
| 40g |
| 40g/mol |
故选A.
点评:本题考查了物质的量、摩尔质量、气体摩尔体积、溶质物质的量浓度概念的分析判断,掌握概念实质是关键,题目较简单.

练习册系列答案
相关题目
下列物质的水溶液能导电,但属于非电解质的是( )
| A、Na2S |
| B、HCl |
| C、NaHCO3 |
| D、NH3 |
下列说法错误的是( )
| A、需要加热才能发生的反应不一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、反应是放热还是吸热取决于反应物和生成物所具有的总能量的相对大小 |
| D、吸热的反应在常温下也可能发生 |
 常温下,向100mL 0.01mol?L-1盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )
常温下,向100mL 0.01mol?L-1盐酸中逐滴加入0.02mol?L-1 MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中不正确的是( )| A、MOH是弱碱 | ||
| B、N点c(Cl-)=c(M+) | ||
C、随着MOH溶液的滴加,比值
| ||
| D、K点对应的溶液c(MOH)+c(OH-)-c(H+)=0.001mol?L-1 |
当光束通过下列分散系时,能产生“丁达尔效应”的是( )
| A、稀硫酸 | B、硫酸铜溶液 |
| C、饱和食盐水 | D、氢氧化铝胶体 |
下列说法中,不正确的是( )
| A、氢氧化铁胶体中分散质微粒直径为1-100nm |
| B、可利用渗析的原理提纯胶体 |
| C、可用丁达尔现象判断胶体的制备是否成功 |
| D、电泳现象说明了胶体带电荷 |
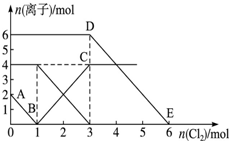 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3mol |
| C、线段AB表示Fe2+被氯气氧化 |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |