题目内容
下列说法中,不正确的是( )
| A、氢氧化铁胶体中分散质微粒直径为1-100nm |
| B、可利用渗析的原理提纯胶体 |
| C、可用丁达尔现象判断胶体的制备是否成功 |
| D、电泳现象说明了胶体带电荷 |
考点:胶体的重要性质
专题:溶液和胶体专题
分析:胶体的微粒直径在1-100nm之间,胶体的性质有:能产生电泳现象;能产生丁达尔现象,能通过滤纸但不能通过半透膜.
解答:
解:A.胶体的微粒直径在1-100nm之间,故A正确.
B、胶体粒子能通过滤纸但不能通过半透膜,小分子、离子可透过半透膜,可利用渗析的原理提纯胶体,故B正确.
C、胶体的微粒直径在1-100nm之间,所以能产生丁达尔现象,故C正确.
D、胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷,故D错误;
故选D.
B、胶体粒子能通过滤纸但不能通过半透膜,小分子、离子可透过半透膜,可利用渗析的原理提纯胶体,故B正确.
C、胶体的微粒直径在1-100nm之间,所以能产生丁达尔现象,故C正确.
D、胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷,故D错误;
故选D.
点评:本题考查了胶体的性质,难度不大,根据教材基础知识解答,要注意D选项,胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷,

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
Ca(OH)2是一种强电解质,它在水溶液中存在溶解平衡Ca(OH)2(s)?Ca2++2OH-.常温下饱和Ca(OH)2溶液的浓度为0.02mol/L,由此求得该溶解平衡常数K的数值是( )
| A、1.6×10-3 |
| B、3.2×10-5 |
| C、8.0×10-6 |
| D、3.1×104 |
 下图表示的一些物质或概念间的从属关系中正确的是( )
下图表示的一些物质或概念间的从属关系中正确的是( )| X | Y | Z | |
| A | 氧化钙 | 氧化物 | 碱性氧化物 |
| B | 盐 | 化合物 | 电解质 |
| C | 胶体 | 分散系 | 混合体系 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
下列反应属于取代反应的是( )
| A、乙炔→乙烯 |
| B、乙醛→乙酸 |
| C、乙醛→乙醇 |
| D、乙醇→溴乙烷 |
下列关于叙述正确的是( )
| A、物质的量是含有一定数目粒子的集合体 |
| B、摩尔质量就是该物质的相对分子质量或相对原子质量 |
| C、单位物质的量的物质所占的体积就是气体摩尔体积 |
| D、40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L |
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
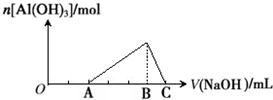

| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104 |
| D、C点溶液中的溶质只有NaAlO2 |
下列物质加入水中,不能形成电解质溶液的是( )
| A、NH3 |
| B、C2H5OH(乙醇) |
| C、NaCl |
| D、HCl |
 为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.