题目内容
7.把300ml含有氯化钡和氯化钠的混合溶液分成三等份,取一份加入含x mol硫酸钾的溶液,恰好使钡离子完全沉淀;另取一份加入含y mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钠离子的物质的量浓度为( )| A. | 0.1(y-2x)mol/L | B. | 10(2x-y)mol/L | C. | 10(y-x)mol/L | D. | 10(y-2x)mol/L |
分析 混合溶液分成三等份,每份溶液浓度相同,一份加入含x mol 硫酸钾的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4);
另一份加入含ymol硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),
再利用电荷守恒可知每份中2n(Ba2+)+n(Na+)=n(Cl-),据此计算每份中n(Na+),根据c=$\frac{n}{V}$计算钠离子浓度.
解答 解:混合溶液分成三等份,每份溶液浓度相同,一份加入含axmol 硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份中n(Ba2+)=(Na2SO4)=xmol;
另一份加入含ymol 硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=ymol,
根据电荷守恒可知每份中2n(Ba2+)+n(Na+)=n(Cl-),每份溶液中n(Na+)=ymol-2xmol=(y-2x)mol,
故钠离子浓度=$\frac{y-2x}{0.1}$mol/L=10(y-2x)mol/L,
故选D.
点评 本题考查物质的量浓度的有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系是解本题关键,注意每一份体积是100mL而不是300mL,为易错点.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4L氧气反应时特移电子数为2NA | |
| B. | 1molCnH2n+2(n≥2)中含有的C-C键数为(n-1)NA | |
| C. | 0.1mol24Mg32S晶体中所含中子总数为28NA | |
| D. | 标准状况下,11.2LSO3所含的分子数目为0.5NA |
15.化合物F是一种医药中间体,其结构简式如图所示,下列有关F的说法正确的是( )
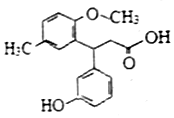

| A. | 所有碳原子可以共平面 | B. | 分子中有1个手性碳原子 | ||
| C. | 能与Na2CO3溶液反应 | D. | 能发生加成、取代、消去反应 |
