题目内容
5.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
装置B中①的名称是萃取,若用CCl4来萃取碘水中的碘,静置后,碘的CCl4溶液在下层,呈紫色;分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)实验方法是A(填代表装置图的字母).
分析 由图可知,B为萃取,用CCl4来萃取碘水中的碘,静置后,CCl4的密度比水的密度大,在下层;乙酸与乙酸乙酯互溶,但沸点不同,以此来解答.
解答 解:装置B中①的名称是萃取,若用CCl4来萃取碘水中的碘,静置后,碘的CCl4溶液在下层,呈紫色;分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)实验方法是A(蒸馏),
故答案为:萃取;下;紫;A.
点评 本题考查混合物分离提纯,为高频考点,把握萃取、分液、蒸馏实验及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意分离方法及原理,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
7.把300ml含有氯化钡和氯化钠的混合溶液分成三等份,取一份加入含x mol硫酸钾的溶液,恰好使钡离子完全沉淀;另取一份加入含y mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钠离子的物质的量浓度为( )
| A. | 0.1(y-2x)mol/L | B. | 10(2x-y)mol/L | C. | 10(y-x)mol/L | D. | 10(y-2x)mol/L |
8.制备Al2Fe(SO4)4•24H2O的实验中,对过滤出产品的母液(pH<1)进行处理.常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是( )
| A. | 通入足量氨气:NH4+、SO42-、OH-、AlO2- | |
| B. | 加入足量Na2O2:Na+、Fe2+、SO42-、OH- | |
| C. | 加入过量稀硝酸:Al3+、Fe3+、H+、NO3-、SO42- | |
| D. | 加入过量漂白粉溶液:Ca2+、Fe2+、Cl-、ClO- |
10.设NA为阿伏加德罗常数,则下列叙述不正确的是( )
| A. | 在标准状况下,22.4L的C6H14所含分子数为NA | |
| B. | 相同质量的H2和Cl2相比,H2的分子数多 | |
| C. | 2.3g金属Na变成Na+时失去的电子数目为0.1NA | |
| D. | 在1L0.1mol/L的HAc溶液中,所含Ac-与HAc之和为0.1NA |
17.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)?Z(g)+W(s);△H>0,下列叙述正确的是( )
| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,一定是n(X):n(Y):n(Z)=1:1:1 | |
| C. | 当容器中气体的平均相对分子质量不变时,一定是V(X):V(Y):V(Z)=1:1:1 | |
| D. | 加入X,上述反应的△H增大 |
14.在下列条件下,可能大量共存的离子组是( )
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO 42-、NO3- |
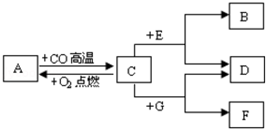 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系: ,
, :
: .
.