题目内容
10.下列叙述中正确的是( )| A. | 除零族元素外,短周期元素原子的最外层电子数等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 副族元素中有非金属元素 | |
| D. | 碱金属元素是指ⅠA族的所有元素 |
分析 A.除零族元素外,短周期元素为主族元素,最外层电子数=族序数;
B.第六周期有32种元素;
C.副族元素均金属元素;
D.ⅠA族含H元素.
解答 解:A.除零族元素外,短周期元素为主族元素,原子结构决定元素的位置,则短周期元素原子的最外层电子数等于该元素所属的族序数,故A正确;
B.第六周期有32种元素,故B错误;
C.副族元素均金属元素,不含非金属元素,故C错误;
D.ⅠA族含H元素,除H外均为碱金属元素,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握主族、副族在周期表中的位置和元素的位置与原子结构的关系为解答的关键,注重基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
20.当光束通过下列分散系时,不可能产生丁达尔效应的是( )
| A. | 墨水 | B. | Fe(OH)3胶体 | C. | CuSO4溶液 | D. | 稀豆浆 |
1.如图所示是四种分子结构的排列方式,其对应的化学式正确的是( )


| A. | A | B. | B | C. | C | D. | D |
18.氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
| A. | 一个D2O分子所含的中子数为8 | B. | NH3的结构式为 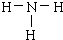 | ||
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | D. | 热稳定性:H2S>HF |
5.下列各组烃的混合物,只要总质量一定,无论它们按什么比例混合,完全燃烧后生成CO2和H2O都是恒量的是( )
| A. | C3H6 C2H4 | B. | C2H4 C2H6 | C. | C3H8 C3H6 | D. | C6H6 C2H2 |
15.已知33As、35Br位于同一周期,下列关系正确的是( )
| A. | 原子半径:As>Cl>Br | B. | 热稳定性:HCl>AsH3>HBr | ||
| C. | 还原性:As3->S2->Cl- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
2.下列说法错误的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与氢键有关 |
19.已知某温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中不正确的是( )
| A. | 反应前,两溶液由水电离的H+浓度相同 | |
| B. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) | |
| C. | 若醋酸溶液加水稀释,溶液中各离子浓度与c(CH3COO-)/c(H+)均减小 | |
| D. | 相同温度,相同浓度的CH3COONH4 与 NaCl溶液,对水的电离程度的影响前者大于后者 |
20.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.
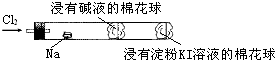
实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )

实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| D. | 管右端棉球外颜色变化可判断氯气是否被碱液完全吸收 |