题目内容
15.已知33As、35Br位于同一周期,下列关系正确的是( )| A. | 原子半径:As>Cl>Br | B. | 热稳定性:HCl>AsH3>HBr | ||
| C. | 还原性:As3->S2->Cl- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
分析 A.电子层越多,原子半径越大,而同一周期元素,原子半径随着原子序数增大而减小;
B.非金属的非金属性越强,其氢化物越稳定;
C.非金属的非金属性越强,其阴离子的还原性越弱;
D.非金属的非金属性越强,其最高价含氧酸的酸性越强.
解答 解:A.原子半径大小顺序是As>Br>Cl,故A错误;
B.非金属性Cl>Br>As,则热稳定性:HCl>HBr>AsH3,故B错误;
C.单质的氧化性Cl2>S>As,所以阴离子的还原性:As3->S2->Cl-,故C正确;
D.非金属性S>P>As,酸性H2SO4>H3PO4>H3AsO4,故D错误;
故选C.
点评 本题考查周期律和周期表的综合应用,为高频考点,把握元素的位置和性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
6.下列能证明氯化氢是共价化合物的实验事实是( )
| A. | 氯化氢不易分解 | B. | 氯化氢溶于水发生电离 | ||
| C. | 液态氯化氢不导电 | D. | 氯化氢的水溶液显酸性 |
3.NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )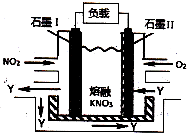

| A. | 放电时,N03-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ附近发生的反应为:NO+O2+e-═NO3- | |
| C. | 电池总反应式为:4NO2+O2═2N2O5 | |
| D. | 当外电路通过4mol e-,负极上共产生2mol N2O5 |
10.下列叙述中正确的是( )
| A. | 除零族元素外,短周期元素原子的最外层电子数等于该元素所属的族序数 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | 副族元素中有非金属元素 | |
| D. | 碱金属元素是指ⅠA族的所有元素 |
20.由短周期元素和长周期元素共同组成的族可能是( )
| A. | 主族 | B. | 副族 | C. | Ⅷ族 | D. | ⅦB族 |
7.下列说法中错误的是( )
| A. | 医院里可以用75%的乙醇溶液杀菌消毒 | |
| B. | 甲烷在空气中燃烧产生淡蓝色火焰,同时放出大量的热 | |
| C. | 乙酸乙酯是具有特殊香味、难溶于水的油状液体 | |
| D. | 无论乙烯还是甲苯,都能使酸性高锰酸钾溶液褪色,这与它们分子内含有碳碳双键有关 |
4.下列有机物的命名正确的是( )
| A. | 3,4,4-甲基己烷 | B. | 2-甲基-4-乙基戊烷 | ||
| C. | 2-甲基-3-戊烯 | D. | 2,2-二甲基戊烷 |
 有如图所示的装置:
有如图所示的装置: