题目内容
12.下表是3种物质的溶解度(20℃),下列说法正确的是( )| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的Ksp=6.82×l0-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |
| B. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 将表中3种物质与水混合,加热蒸干、灼烧,最终的固体产物不相同 | |
| D. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
分析 A.当溶液中含有其他镁离子或碳酸根离子时,碳酸根离子浓度和镁离子浓度不一定相同;
B.氢氧化镁溶解度小于碳酸镁,反应生成氢氧化镁沉淀;
C.氯化镁溶液蒸干得到水解产物,灼烧得到氧化镁,氢氧化镁蒸干灼烧得到氧化镁,碳酸镁溶液加热得到氢氧化镁,灼烧得到氧化镁;
D.碳酸镁是微溶于水的物质,需要用氢氧化钠溶液除去.
解答 解:A.MgCO3的Ksp=6.82×l0-6,则Ksp(MgCO3)=c(Mg2+)•c(CO32-)=6.82×10-6,由于Mg2+、CO32-的浓度相互有影响,当含有其他镁离子或碳酸根离子的混合溶液中,c(Mg2+)、c(CO32-)不一定相同,故A错误;
B.用石灰水处理含有Mg2+、HCO3-硬水,氢氧化镁溶解度小于碳酸镁,反应生成氢氧化镁沉淀,发生反应的离子方程式为:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O,故B正确;
C.HCl易挥发,氯化镁溶液蒸干得到Mg(OH)2,灼烧得到MgO;Mg(OH)2蒸干灼烧得到MgO;MgCO3溶液加热得到Mg(OH)2,灼烧得到MgO,所以将表中三种物质与水混合,加热、灼烧,最终所得的固体产物相同,故C错误;
D.碳酸镁是微溶于水的物质,除去粗盐中含有的MgCl2杂质,加入为Na2CO3溶液不能除净,最佳的除杂试剂为NaOH溶液,故D错误;
故选B.
点评 本题考查沉淀难溶物溶解平衡及应用,题目难度中等,涉及溶解平衡及其影响、溶度积常数的分析应用、盐的水解原理、物质分离与提纯等知识,注意氢氧化镁溶解度小于碳酸镁,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H.
表所列数据是该反应在不同温度下的化学平衡常数(K):
(1)根据表中数据可判断△H<0 (填“>”、“=”或“<”).
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A(填序号):
A.正向移动 B.逆向移动 C.处于平衡状态 D.无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
表所列数据是该反应在不同温度下的化学平衡常数(K):
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A(填序号):
A.正向移动 B.逆向移动 C.处于平衡状态 D.无法判断
(3)下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
3.在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;再充入CO2气体,则平衡正向移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K不变(选“增大”、“减小”或“不变”).
(2)该反应的逆反应方向为放热反应方向(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为830℃.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;再充入CO2气体,则平衡正向移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K不变(选“增大”、“减小”或“不变”).
(2)该反应的逆反应方向为放热反应方向(选填吸热、放热).
(3)能判断该反应是否达到化学平衡状态的依据是bc(多选扣分).
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为830℃.
4.250C时,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7.则两种溶液的体积比是( )
| A. | 10:1 | B. | 1:10 | C. | 1:2 | D. | 2:1 |


 ,E中含氧官能团的名称为羟基、碳碳三键.
,E中含氧官能团的名称为羟基、碳碳三键. .
. .
. (任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母).
(任写一种).F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是d(填字母). ,其他试剂任选.
,其他试剂任选.
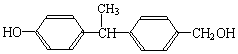 b.
b.
 d.
d.
 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
 .
.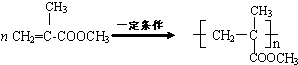 .
. (称为羟醛缩合反应)
(称为羟醛缩合反应)
 .
. .
. ;
; .
.