题目内容
4.250C时,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7.则两种溶液的体积比是( )| A. | 10:1 | B. | 1:10 | C. | 1:2 | D. | 2:1 |
分析 pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,混和液pH=7,则n(H+)=n(OH-),再结合n=cV列式计算.
解答 解:pH=2的H2SO4溶液中c(H+)=10-2mol/L,
pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,
混和液pH=7,说明两溶液恰好中和,则n(H+)=n(OH-),
即:V[H2SO4(aq)]•c(H+)=V[NaOH(aq)]•c(OH-),
所以V[H2SO4(aq)]:V[NaOH(aq)]=c(OH-):c(H+)=10-3mol/L:10-2mol/L=1:10.
故选B.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
12.下表是3种物质的溶解度(20℃),下列说法正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.00084 | 0.01 |
| A. | 已知MgCO3的Ksp=6.82×l0-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 | |
| B. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生反应的离子方程式:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 将表中3种物质与水混合,加热蒸干、灼烧,最终的固体产物不相同 | |
| D. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
1.下列关于钠的说法,正确的是( )
| A. | 金属钠与氧气反应,条件不同产物不同 | |
| B. | 金属钠着火可用水扑灭 | |
| C. | 少量的钠可保存在汽油里 | |
| D. | 钠的化学性质活泼,可从硫酸铜溶液中置换出铜 |
8.氮的固定是几百年来科学家一直研究的课题.
(1)表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р1<р1.(填“<”、“>”或者“=”)

(1)表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2 (g)+O2 (g)?2NO(g) | 工业固氮 N2 (g)+3H2 (g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р1<р1.(填“<”、“>”或者“=”)

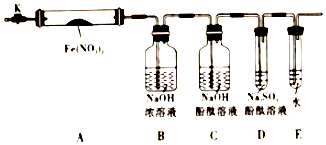 固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
 +H2O
+H2O
 ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.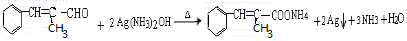 .
. .
.