题目内容
9.关于如图所示各装置的叙述中,正确的是( )| A. | 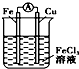 装置是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  装置研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-═Fe2+ | |
| C. | 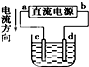 若用装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| D. | 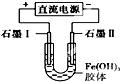 装置通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
分析 A.在原电池中,较为活泼的金属是负极,据此确定自发的氧化还原反应的书写;
B.在中性环境下,金属发生的是吸氧腐蚀,金属失电子被氧化;
C.根据电解池的工作原理结合电流方向来回答判断;
D.电泳试验证明胶体的胶粒是带有电性的.
解答 解:A、装置是原电池,金属铁的活泼性强,能和氯化铁之间反应,总反应是:Fe+2Fe3+=3Fe2+,故A错误;
B.在中性环境下,金属发生的是吸氧腐蚀,Fe上的反应为Fe-2e-=Fe2+,故B错误;
C.根据电流方向,a是电源的正极,b是负极,精炼铜,则阳极c极为粗铜,阴极d极为纯铜,电解质溶液为CuSO4溶液,故C错误;
D.氢氧化铁胶体中的胶粒带正电,在电源作用下,会移向电解池的阴极,即通电一段时间后石墨Ⅱ电极附近溶液红褐色加深,故D正确;
故选D.
点评 本题考查了电解质、原电池工作原理,题目难度中等,明确原电池和电解池的工作原理为解答关键,注意掌握电极的判断方法及电极反应式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
19.某无色溶液中可能含有Na+、K+、NH4+、Cu2+、SO42-、SO32-、MnO4-、Cl-、Br-、CO32--.用pH试纸检验该溶液,溶液的pH>7,且往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成.某同学另取少量原溶液,设计并完成了如下实验:

则关于原溶液的判断中不正确的是( )

则关于原溶液的判断中不正确的是( )
| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+、另需实验验证 | |
| B. | 肯定存在的离子是SO32-、Br-,且Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
17.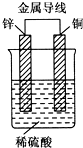 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
4.关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
| A. | 配位体是Cl-和H2O,配位数是8 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀 |
14.电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )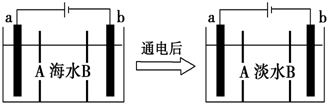

| A. | A膜是阳离子交换膜(只允许阳离子通过) | |
| B. | 通电后,海水中阴离子往b电极处运动 | |
| C. | 通电后,a电极的电极反应为4OH-4e-═O2↑+2H2O | |
| D. | 通电后,b电极上产生无色气体,溶液中出现少量白色沉淀 |
1.下列解释事实的方程式不正确的是( )
| A. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| B. | 0.1 mol•L-1氨水的pH为11:NH3•H2O?NH4++OH- | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO${\;}_{3}^{-}$+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 一定条件下,0.1 mol N2和0.3 mol H2充分反应放出热量小于9.2 kJ:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 |
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )
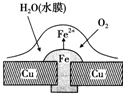

| A. | 正极的电极反应为:2H++2e-═H2↑ | |
| B. | 此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此过程中铜并不被腐蚀 | |
| D. | 此过程中电子从Fe移向Cu |
19.下列物质属于含有共价键的离子化合物的是( )
| A. | MgCl2 | B. | Na202 | C. | K20 | D. | H202 |