题目内容
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )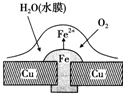
| A. | 正极的电极反应为:2H++2e-═H2↑ | |
| B. | 此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此过程中铜并不被腐蚀 | |
| D. | 此过程中电子从Fe移向Cu |
分析 根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应生成氢氧根离子,亚铁离子与氢氧根离子结合生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,原电池放电时,电子从负极流向正极,据此分析.
解答 解:根据图片知,水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀.
A、中性或弱碱性条件下,氧气得电子生成氢氧根离子,则正极上的电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B、负极上发生的电极反应式为:Fe-2e-=Fe2+,正极上的电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,故B正确;
C、该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C正确;
D、该原电池放电时,外电路上电子从负极铁流向正极铜,故D正确;
故选A.
点评 本题以原电池原理为载体考查了金属的腐蚀,难度不大,明确钢铁发生析氢腐蚀和吸氧腐蚀的条件是解本题的关键,注意钢铁的吸氧腐蚀中还含有氢氧化亚铁生成氢氧化铁的反应.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
9.关于如图所示各装置的叙述中,正确的是( )
| A. | 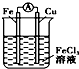 装置是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2 | |
| B. |  装置研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-═Fe2+ | |
| C. | 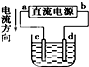 若用装置精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 | |
| D. | 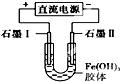 装置通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
13.将等质量的铜片在酒精灯上加热后,分别插入下列溶液后静置片刻,铜片质量增加的是( )
| A. | 醋酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
3.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
| A. | 电池工作时,锌失去电子,电解液内部OH-向负极移动 | |
| B. | 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
10.下列物质不属于合金的是( )
| A. | 钢 | B. | 水银 | C. | 黄铜 | D. | 硬铝 |
7.下列关于工业合成氨的叙述正确的是( )
| A. | 合成氨工业温度选择为700K左右,只要是为了提高NH3产率 | |
| B. | 使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响 | |
| C. | 合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率 | |
| D. | 合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度 |
8.有核磁共振氢谱如图,下列有机物符合该图谱的是( )


| A. |  | B. |  | C. |  | D. |  |
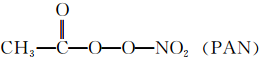 等二次污染物.
等二次污染物. 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.