题目内容
下列装置或操作能达到实验目的是( )
A、 分离水和CCl4 |
B、 定容 |
C、 比较两种盐的热稳定性 |
D、 构成铜锌原电池 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.水与四氯化碳混合分层,水的密度小,水在上层;
B.水加至离刻度线1~2cm处改用胶头滴管定容;
C.碳酸氢钠受热易分解,而碳酸钠不分解;
D.左侧烧杯中发生化学反应,不能形成原电池.
B.水加至离刻度线1~2cm处改用胶头滴管定容;
C.碳酸氢钠受热易分解,而碳酸钠不分解;
D.左侧烧杯中发生化学反应,不能形成原电池.
解答:
解:A.水与四氯化碳混合分层,水的密度小,水在上层,图中分液装置合理,故A正确;
B.水加至离刻度线1~2cm处改用胶头滴管定容,图中定容时水加的太少,故B错误;
C.碳酸氢钠受热易分解,而碳酸钠不分解,则小试管中应为碳酸氢钠,故C错误;
D.左侧烧杯中发生化学反应,不能形成原电池,则左侧烧杯中应为硫酸锌,右侧烧杯中为硫酸铜可形成原电池,故D错误;
故选A.
B.水加至离刻度线1~2cm处改用胶头滴管定容,图中定容时水加的太少,故B错误;
C.碳酸氢钠受热易分解,而碳酸钠不分解,则小试管中应为碳酸氢钠,故C错误;
D.左侧烧杯中发生化学反应,不能形成原电池,则左侧烧杯中应为硫酸锌,右侧烧杯中为硫酸铜可形成原电池,故D错误;
故选A.
点评:本题考查化学实验方案的评价,涉及分液、溶液配制、稳定性比较及原电池,侧重混合物分离提纯、物质性质实验的基本操作和化学反应原理的考查,题目难度不大.

练习册系列答案
相关题目
下列各组离子因发生氧化还原反应而不能大量共存的是( )
| A、Mg2+、Cl-、CO32- |
| B、NH4+、Ba2+、OH- |
| C、S2-、H+、SO32- |
| D、Fe3+、Cl-、SCN- |
铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l),下列说法正确的是( )
| 放电 |
| 充电 |
| A、放电时,负极的电极反应式为:Pb-2e-═Pb2+ |
| B、放电时,正极得电子的物质是PbO2 |
| C、充电时,电解质溶液中硫酸浓度减小 |
| D、充电时,阴极的电极反应式为:PbSO4-2e-+2H2O═PbO2+4H++SO42- |
下列离子方程式正确的是( )
| A、铁与稀硫酸反应:Fe+6H+=2Fe3++3H2↑ |
| B、用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O |
| C、碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、氢氧化钡溶液与硫酸溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
铅蓄电池的电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l);下列说法正确的是( )
| 充电 |
| 放电 |
| A、放电时覆盖Pb的电极为正极,发生还原反应 |
| B、放电时电解质溶液中的H+向正极移动 |
| C、充电时阳极的电极反应为:PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
| D、充电是阳极附近电解质溶液的pH逐渐增大 |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、0.1mol/L的NaOH溶液中钠离子数为0.1NA |
| B、1.8g重水(D2O)中,含有的质子数为0.1NA |
| C、5.6g铁投入浓硫酸中,生成的气体分子数为0.1NA |
| D、标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
下列表述正确的是( )
| A、0.1mol?L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3] |
| B、0.1mol?L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-] |
| C、CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c (Na2CO3)<c(CH3COONa) |
| D、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+] |
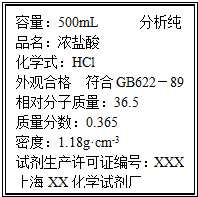 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.