题目内容
 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.(1)求原混合物中Na2CO3的质量分数.
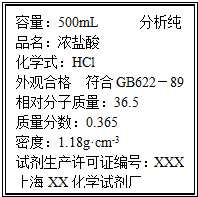
(2)若100mL2.50mol?L-1的盐酸是用标签如图所示的浓盐酸制得,则需该浓盐酸的体积是多少?
(3)若取等质量的原混合物配成溶液,逐滴滴入90mL 2.50mol?L-1的盐酸,并不断搅拌,求生成的气体在标准状况下的体积.
考点:有关混合物反应的计算
专题:计算题
分析:(1)设出碳酸钠、碳酸氢钠的物质的量,根据混合物质量、生成消耗氯化氢的物质的量计算出碳酸钠、碳酸氢钠的物质的量,再计算出混合物中碳酸钠的质量分数;
(2)先根据c=
计算出浓盐酸的物质的量浓度,然后根据溶液稀释过程中溶质的物质的量不变计算出需要浓盐酸的体积;
(3)100mL 2.50mol?L-1的盐酸恰好完全反应,90mL盐酸不足,碳酸钠先参与反应生成碳酸氢钠,根据氯化氢的物质的量、碳酸钠转化成碳酸氢钠消耗的物质的量计算出与碳酸氢钠反应的氯化氢的物质的量,再根据反应计算出生成的二氧化碳的体积.
(2)先根据c=
| 1000ρw |
| M |
(3)100mL 2.50mol?L-1的盐酸恰好完全反应,90mL盐酸不足,碳酸钠先参与反应生成碳酸氢钠,根据氯化氢的物质的量、碳酸钠转化成碳酸氢钠消耗的物质的量计算出与碳酸氢钠反应的氯化氢的物质的量,再根据反应计算出生成的二氧化碳的体积.
解答:
解:(1)设混合物中Na2CO3和NaHCO3的物质的量分别为x、y,
NaHCO3+HCl═NaCl+CO2↑+H2O
1 1
y y
Na2CO3+2HCl═2NaCl+CO2↑+H2O
1 2
x 2x
则:106x+84y=14.8g
2x+y=0.100L×2.50mol?L-1=0.250mol,
解得:x=0.100mol,y=0.0500mol,
ω(Na2CO3)=
×100%≈71.6%,
答:原混合物中Na2CO3的质量分数为71.6%;
(2)该浓盐酸的物质的量浓度为:c(HCl)=
mol/L=11.8mol/L,
溶液在稀释过程中溶质的物质的量不变,则需要浓盐酸的体积为:V[HCl(aq)]=
≈0.0212L=21.2mL,
答:需该浓盐酸的体积是21.2mL;
(3)由于恰好完全反应需100mL 2.50mol?L-1的盐酸,故加90mL时,盐酸不足,碳酸钠先反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成二氧化碳,
90mL 2.50mol?L-1的盐酸中含有氯化氢的物质的量为:2.5mol/L×0.09L=0.225mol,
Na2CO3+HCl=NaHCO3+NaCl
1 1
0.100mol 0.1000mol,
则与碳酸氢钠反应的HCl的物质的量为:0.225mol-0.100mol=0.125mol,
NaHCO3+HCl=NaCl+H2O+CO2↑
1mol 22.4L
0.125mol V
V(CO2)=
=2.8L,
答:生成的气体在标准状况下的体积为2.8L.
NaHCO3+HCl═NaCl+CO2↑+H2O
1 1
y y
Na2CO3+2HCl═2NaCl+CO2↑+H2O
1 2
x 2x
则:106x+84y=14.8g
2x+y=0.100L×2.50mol?L-1=0.250mol,
解得:x=0.100mol,y=0.0500mol,
ω(Na2CO3)=
| 106g/mol×0.100mol |
| 14.8g |
答:原混合物中Na2CO3的质量分数为71.6%;
(2)该浓盐酸的物质的量浓度为:c(HCl)=
| 1000×1.18×36.6 |
| 36.5 |
溶液在稀释过程中溶质的物质的量不变,则需要浓盐酸的体积为:V[HCl(aq)]=
| 2.50mol/L×0.1L |
| 11.8mol/L |
答:需该浓盐酸的体积是21.2mL;
(3)由于恰好完全反应需100mL 2.50mol?L-1的盐酸,故加90mL时,盐酸不足,碳酸钠先反应生成碳酸氢钠,然后碳酸氢钠与盐酸反应生成二氧化碳,
90mL 2.50mol?L-1的盐酸中含有氯化氢的物质的量为:2.5mol/L×0.09L=0.225mol,
Na2CO3+HCl=NaHCO3+NaCl
1 1
0.100mol 0.1000mol,
则与碳酸氢钠反应的HCl的物质的量为:0.225mol-0.100mol=0.125mol,
NaHCO3+HCl=NaCl+H2O+CO2↑
1mol 22.4L
0.125mol V
V(CO2)=
| 22.4L×0.125mol |
| 1mol |
答:生成的气体在标准状况下的体积为2.8L.
点评:本题考查了有关混合物的计算,题目难度中等,明确碳酸钠、碳酸氢钠与氯化氢反应的方程式是解题关键,注意掌握有关混合物的计算方法,能够根据溶液的密度、质量分数计算出溶质的物质的量浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl ⑥NH3?H2O ⑦CH3COONH4;按c(NH4+)由小到大的排列顺序正确的是( )
| A、③⑦⑤④⑥①②③ |
| B、⑥③⑦⑤④①② |
| C、⑥⑦⑤③④①② |
| D、⑥⑦③⑤④②① |
如图是“MnO2对H2O2分解反应速率影响研究”的流程示意图.下列有关说法不正确的是( )

| A、实验时先加H2O2后加MnO2有利于增大固液接劁 |
| B、为使实验顺利进行,H2O2不宜从图Ⅱ漏斗处加入 |
| C、Ⅱ、Ⅲ处均可观察到迅速产生大量气泡,余烬复燃 |
| D、上述流程中不宜先加入MnO2再插入带余烬的木条 |
下列装置或操作能达到实验目的是( )
A、 分离水和CCl4 |
B、 定容 |
C、 比较两种盐的热稳定性 |
D、 构成铜锌原电池 |
“常娥一号”的成功发射标志着我国已具有深太空探测能力.据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以
He的形式存在.下列说法正确的是( )
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
 硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题: