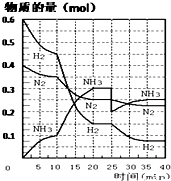
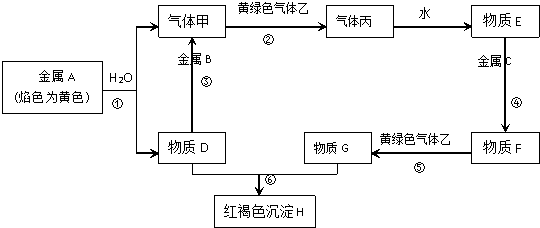
题目内容
8.25℃时,pH=13的强碱溶液与0.01mol•L-1 c(H+)的强酸溶液混合,所得混合液的pH=12,则强碱与强酸的体积比是( )| A. | 11:1 | B. | 9:1 | C. | 1:11 | D. | 2:9 |
分析 pH=13的强碱溶液中c(OH-)=0.1mol/L,强酸溶液中c(H+)=0.01mol/L,混合液的pH=12,c(OH-)=0.01mol/L,即两溶液混合后碱过量,故有:c(OH-)=0.01mol/L=$\frac{0.1mol/L×{V}_{碱}-0.01mol/L×{V}_{酸}}{{V}_{酸}+{V}_{碱}}$,据此分析.
解答 解:pH=13的强碱溶液中c(OH-)=0.1mol/L,强酸溶液中c(H+)=0.01mol/L,混合液的pH=12,故c(OH-)=0.01mol/L,即两溶液混合后碱过量,设酸的体积为V酸,碱的体积为V碱,故有:c(OH-)=0.01mol/L=$\frac{0.1mol/L×{V}_{碱}-0.01mol/L×{V}_{酸}}{{V}_{酸}+{V}_{碱}}$,解得V酸:V碱=2:9,故选D.
点评 本题考查了溶液酸碱性与溶液pH的简单计算,题目难度不大,试题侧重基础知识的考查,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的计算方法.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
10.在体积为V L的恒容密闭容器中加入6mol CO和H2的混合气体,在不同条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图1表示有、无催化剂时反应的能量变化,图2表示平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系.下列叙述正确的是( )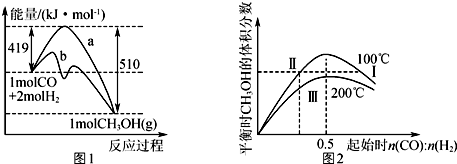

| A. | 正反应的△H=91 kJ•mol-1,曲线b表示使用了催化剂 | |
| B. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) | |
| C. | 平衡时CO的转化率:α(CO,状态Ⅰ)<α(CO,状态Ⅱ) | |
| D. | n(CO):n(H2)=0.5时,平衡时CH3OH的物质的量浓度:c(CH3OH,1 00℃)<c(CH3OH,200℃) |
19.下列叙述正确的是( )
| A. | 同周期元素的原子半径以 VIIA 族的为最大 | |
| B. | 在周期表中零族元素的单质全部是气体 | |
| C. | IA、IIA 族元素的原子,其半径越大就越容易得电子 | |
| D. | 所有主族元素的最高正价数都和它的族序数相等 |
16.对于反应:2SO2+O2?2SO3,下列说法不正确的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 通入过量的O2可以使SO2转化率达到100% | |
| C. | 升高温度可以增大反应速率 | |
| D. | 增大O2浓度可以增大反应速率 |
13.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 | |
| B. | 氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═=BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
17.能正确表示下列反应的离子方程式的是( )
| A. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | CO2通入苯酚钠溶液:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |