题目内容
15.若原子的最外层电子排布为ns1的元素R的叙述正确的是( )| A. | 一定是ⅠA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能不是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
分析 已知某元素的原子的最外层电子排布是ns1,若为主族元素,则为第IA族,若为过渡金属元素,则为第VIB或IB元素,据此分析.
解答 解:已知某元素的原子的最外层电子排布是ns1,若为主族元素,则为第IA族,有氢和其它的碱金属;若为过渡金属元素,则为第VIB或IB元素,所以可能是非金属元素也可能是金属元素,故选C.
点评 本题考查了最外层电子排布与元素在周期表中位置的关系,题目难度不大,注意最外层电子排布是ns1,该元素可能在主族也可能在副族.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
8.现有a mol/L NaX和b mol/L NaY两种盐溶液.下列说法不正确的是(若是溶液混合,则忽略混合时的体积变化)( )
| A. | 若a=b且pH(NaX)>pH(NaY),则酸性HX<HY | |
| B. | 若a=b且c(X -)=c(Y -)+c(HY),则酸性HX>HY | |
| C. | 若a>b且c(X -)=c(Y -),则酸性HX<HY | |
| D. | 若a=0.1mol/L且两溶液等体积混合,则c(X -)+c(HX)=0.1mol/L |
8.电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示,下列说法不正确的是( )
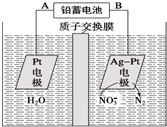

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的总反应方程式为:2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| C. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
4.A、B、C均为短周期元素,A、B周周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构.下列叙述一定不正确的是( )
| A. | 它们的原子序数B>A>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
7.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 23g Na在空气中完全燃烧,转移的电子数为1 mol | |
| B. | 78gNa2O2含有的离子数为3NA | |
| C. | 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1NA | |
| D. | 5.4 g铝与足量NaOH溶液反应,产生6.72L的氢气 |
5.常温下,下列溶液中微粒的物质的量浓度关系不正确的( )
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | 常温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-) | |
| C. | NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 浓度均为0.1mol/L的①NH4Cl ②NH3•H2O ③NH4HSO4 ④NH4HCO3四种溶液,c(NH4+)由大到小的顺序为:③>①>④>② |
 回答下列问题.
回答下列问题.