题目内容
4.A、B、C均为短周期元素,A、B周周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构.下列叙述一定不正确的是( )| A. | 它们的原子序数B>A>C | B. | 它们的离子半径A2->C->B2+ | ||
| C. | 它们的原子半径C>B>A | D. | 它们的最外层电子数C>A>B |
分析 由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素或H元素,A、B同周期、B2+和C-具有相同的电子层结构,则A、B在C的下一周期,则可推知A为S元素、B为Mg元素、C为F元素,或者A为O、B为Be、C为H,据此解答.
解答 解:由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素或H元素,A、B同周期、B2+和C-具有相同的电子层结构,则A、B在C的下一周期,可推知A为S元素、B为Mg元素、C为F元素,或者A为O、B为Be、C为H.
A.由上述分析可知,原子序数A>B>C,故A错误;
B.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径A2->C->B2+,故B正确;
C.同周期原子半径从左到右逐渐减小,电子层数越多原子半径越大,原子半径B>A>C,故C错误;
D.A为S元素,B为Mg元素,C为F元素,最外层电子数分别为6、2、7,所以最外层电子数C>A>B,故D正确,
故选AC.
点评 本题考查原子结构与元素周期律的关系,难度中等,关键是根据原子结构特点正确推断元素的种类,学生容易忽略C为H元素情况,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3 | 验证火柴头含有氯元素 |
| B | 试样加水溶解后,再加入足量Ba(OH)2溶液,有白色沉淀生成 | 检验NaHCO3固体中是否含 Na2CO3 |
| C | 向溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
12.下列变化属于化学变化的有( )
①木材干馏制焦炭
②甘油加水作护肤剂
③将溴水滴入CCl4中振荡后褪色
④蛋白质水溶液中加入浓硫酸铵有沉淀析出
⑤用福尔马林溶液浸泡动物的尸体
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
⑦Na2CO3•10H2O在干燥空气中失水
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀
⑨电解饱和食盐水制H2、Cl2、NaOH.
①木材干馏制焦炭
②甘油加水作护肤剂
③将溴水滴入CCl4中振荡后褪色
④蛋白质水溶液中加入浓硫酸铵有沉淀析出
⑤用福尔马林溶液浸泡动物的尸体
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
⑦Na2CO3•10H2O在干燥空气中失水
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀
⑨电解饱和食盐水制H2、Cl2、NaOH.
| A. | ①②④⑥ | B. | ⑤⑥⑦⑨ | C. | ①⑤⑥⑦⑨ | D. | ②③④ |
19.在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )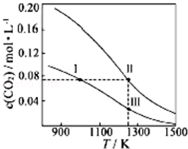

| A. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| B. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| C. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
9. 对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
 对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )
对于可逆反应:mA(g)+nB(g)?xC(g);△H=?,在不同温度及压强条件下,反应物A的转化率如图所示,下列判断正确的是( )| A. | △H>0,m+n>x | B. | △H>0,m+n<x | C. | △H<0,m+n<x | D. | △H<0,m+n>x |
15.若原子的最外层电子排布为ns1的元素R的叙述正确的是( )
| A. | 一定是ⅠA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能不是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
12.下列叙述不正确的是( )
| A. | 热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 | |
| B. | 物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=13的强碱溶液,加水稀释后,溶液中氢离子的浓度变小 | |
| D. | 25℃时pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,溶液中由水电离产生的氢离子的浓度之比为104 |
13.下列离子方程式正确的是( )
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO32-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| C. | 醋酸钠溶液和盐酸混合:CH3COONa+H+═CH3COOH+Na+ | |
| D. | 铁跟氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |