题目内容
8.电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示,下列说法不正确的是( )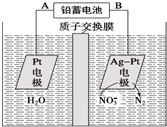
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的总反应方程式为:2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| C. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
分析 A.该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,A应为正极;
B.硝酸根离子被还原生成氮气,阳极生成氧气;
C.阴极上硝酸根离子得电子发生还原反应;
D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室.
解答 解:A.根据图知,电解槽右边部分N元素化合价由+5价变为0价,所以硝酸根离子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,所以A是正极,电极材料为PbO2,故A正确;
B.硝酸根离子被还原生成氮气,阳极生成氧气,电解总方程式为2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH-,故B正确;
C.阴极上硝酸根离子得电子发生还原反应,氢离子通过质子交换膜进入右侧,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,故C正确;
D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阴极的电极反应式为2NO3-+6H++10e-=N2↑+6OH-,转移2mol电子,阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故D错误.
故选D.
点评 本题考查了电解原理,为高频考点,根据N元素化合价变化确定阴阳极、正负极,难点是电极反应式的书写,易错选项是D,注意氢离子还进入阴极室,很多同学往往只考虑析出的气体而导致错误,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.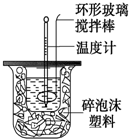 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)倒入NaOH溶液的正确操作是C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后成溶液的比热容c=4.18J/(g•℃).利用上表数据计算该反应放出的热量为:1.4212kJ.
(4)利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和反应的反应热的实验步骤如下:
利用如图装置测定中和反应的反应热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)倒入NaOH溶液的正确操作是C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
(4)利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差; b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度; c.量取NaOH溶液的体积时仰视读数; d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
20.下列有关物质应用说法错误的是( )
| A. | 小苏打可以做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为供氧剂 | |
| C. | 铁红常用作红色油漆或涂料 | |
| D. | 钠可以从硫酸铜溶液中置换出铜 |
17.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3 | 验证火柴头含有氯元素 |
| B | 试样加水溶解后,再加入足量Ba(OH)2溶液,有白色沉淀生成 | 检验NaHCO3固体中是否含 Na2CO3 |
| C | 向溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
12.下列变化属于化学变化的有( )
①木材干馏制焦炭
②甘油加水作护肤剂
③将溴水滴入CCl4中振荡后褪色
④蛋白质水溶液中加入浓硫酸铵有沉淀析出
⑤用福尔马林溶液浸泡动物的尸体
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
⑦Na2CO3•10H2O在干燥空气中失水
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀
⑨电解饱和食盐水制H2、Cl2、NaOH.
①木材干馏制焦炭
②甘油加水作护肤剂
③将溴水滴入CCl4中振荡后褪色
④蛋白质水溶液中加入浓硫酸铵有沉淀析出
⑤用福尔马林溶液浸泡动物的尸体
⑥烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
⑦Na2CO3•10H2O在干燥空气中失水
⑧在Fe(OH)3胶体中加入硅酸溶胶而出现沉淀
⑨电解饱和食盐水制H2、Cl2、NaOH.
| A. | ①②④⑥ | B. | ⑤⑥⑦⑨ | C. | ①⑤⑥⑦⑨ | D. | ②③④ |
19.在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )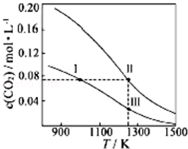

| A. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| B. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| C. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
15.若原子的最外层电子排布为ns1的元素R的叙述正确的是( )
| A. | 一定是ⅠA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能不是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
16.现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-.
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.

 .
.