题目内容
7.设NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 23g Na在空气中完全燃烧,转移的电子数为1 mol | |
| B. | 78gNa2O2含有的离子数为3NA | |
| C. | 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1NA | |
| D. | 5.4 g铝与足量NaOH溶液反应,产生6.72L的氢气 |
分析 A.钠在化合物中的化合价为+1价,23g钠的物质的量为1mol;
B.质量转化为物质的量,结合过氧化钠中含有钠离子和过氧根离子解答;
C.依据化学方程式:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,计算分析;
D.气体状况未知.
解答 解:A.钠在化合物中的化合价为+1价,23g钠的物质的量为1mol,完全反应转移了1mol电子,故A正确;
B.过氧化钠中阴离子为过氧根离子,78g Na2O2的物质的量为1mol,1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总共含有3mol离子,离子数为3NA,故B正确;
C.依据化学方程式定量关系计算,3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,0.10mol Fe粉与足量水蒸气反应生成的H2分子数为$\frac{0.4}{3}$NA,故C错误;
D.气体状况未知,Vm不确定,不能计算生成氢气的体积,故D错误;
故选:AB.
点评 本题考查了阿伏伽德罗常数的分析判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠的结构,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列有关物质应用说法错误的是( )
| A. | 小苏打可以做发酵粉 | |
| B. | 过氧化钠可用于呼吸面具或潜水艇中作为供氧剂 | |
| C. | 铁红常用作红色油漆或涂料 | |
| D. | 钠可以从硫酸铜溶液中置换出铜 |
19.在体积均为1.0L的恒容密闭容器中加入足量的相同的炭粉,再 分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )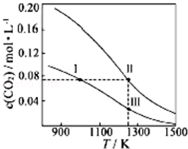

| A. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| B. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| C. | 体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
15.若原子的最外层电子排布为ns1的元素R的叙述正确的是( )
| A. | 一定是ⅠA族元素 | |
| B. | 一定是金属元素 | |
| C. | 可能不是金属元素也可能是非金属元素 | |
| D. | 不是ⅡA族元素就是副族元素 |
12.下列叙述不正确的是( )
| A. | 热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 | |
| B. | 物质的量浓度相等的H2S和NaHS混合溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=13的强碱溶液,加水稀释后,溶液中氢离子的浓度变小 | |
| D. | 25℃时pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,溶液中由水电离产生的氢离子的浓度之比为104 |
19.碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )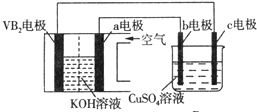

| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
16.现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-.
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)少量的④通入⑥的溶液中反应的离子方程式为CO2+Ba2++2OH-=BaCO3↓+H2O
(4)②与⑨发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6.
16.下列叙述不正确的是( )
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |