题目内容
有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的最高正化合价与其最低负化合价相等,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
(1)写出A、B、C、D元素的名称:A ,C
(2)用电子式表示B与C形成的化合物的形成过程: .
(3)A和过量的B的单质充分反应生成化合物的结构式是 .
(4)B与D形成的化合物是离子化合物还是共价化合物?如何证明? ; .
(1)写出A、B、C、D元素的名称:A
(2)用电子式表示B与C形成的化合物的形成过程:
(3)A和过量的B的单质充分反应生成化合物的结构式是
(4)B与D形成的化合物是离子化合物还是共价化合物?如何证明?
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,B原子L层的电子总数是K层的3倍,则B为氧元素,A和B在同一周期,A的最高正化合价与其最低负化合价相等,则A为碳元素,0.1mol C单质能从酸中置换出2.24L氢气(标准状况),说明C为最外层有2个电子,同时它的电子层结构变成与氖原子的电子层结构相同,则C为镁元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,则D为铝元素,据此答题.
解答:
解:A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,B原子L层的电子总数是K层的3倍,则B为氧元素,A和B在同一周期,A的最高正化合价与其最低负化合价相等,则A为碳元素,0.1mol C单质能从酸中置换出2.24L氢气(标准状况),说明C为最外层有2个电子,同时它的电子层结构变成与氖原子的电子层结构相同,则C为镁元素,D离子的半径比C离子的小,D离子与B离子的电子层结构相同,则D为铝元素,
(1)由上面的分析可知,A、C元素的名称分别为碳、镁,
故答案为:碳;镁;
(2)B与C形成的化合物为氧化镁,用电子式表示氧化镁的形成过程为 ,
,
故答案为: ;
;
(3)碳和过量的氧气充分反应生成二氧化碳,二氧化碳的结构式是O=C=O,
故答案为:O=C=O;
(4)氧化铝是离子化合物,可以通过熔融氧化铝能导电这一事实证明它是离子化合物,
故答案为:离子化合物;氧化铝在熔融条件下能导电;
(1)由上面的分析可知,A、C元素的名称分别为碳、镁,
故答案为:碳;镁;
(2)B与C形成的化合物为氧化镁,用电子式表示氧化镁的形成过程为
 ,
,故答案为:
 ;
;(3)碳和过量的氧气充分反应生成二氧化碳,二氧化碳的结构式是O=C=O,
故答案为:O=C=O;
(4)氧化铝是离子化合物,可以通过熔融氧化铝能导电这一事实证明它是离子化合物,
故答案为:离子化合物;氧化铝在熔融条件下能导电;
点评:本题主要考查了电子式、结构式、离子化合物的特征等知识,中等难度,解题的关键在于元素推断,解题时要注意根据原子结构特点,和在反应中的化合价的变化确定元素种类.

练习册系列答案
相关题目
对Fe(OH)3胶体和FeCl3溶液的比较,下列不正确的是( )
| A、可用丁达尔现象区别 |
| B、加入硫酸镁溶液前者会浑浊而后者无明显现象 |
| C、可用渗析的方法分离 |
| D、可用过滤的方法分离 |
A、B、C、D、E五种元素同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下: ,下列说法中正确的是( )
,下列说法中正确的是( )
 ,下列说法中正确的是( )
,下列说法中正确的是( )| A、D元素的负化合价为-2价时,E元素的最高化合价一定为+7 |
| B、B(OH)m为强碱时,A(OH)n也一定为强碱 |
| C、HnDOm为强酸时,E的非金属性一定很强 |
| D、HnCOm为强酸时,E的单质可能有强还原性 |
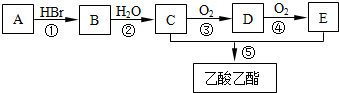
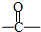
 ,反应④的化学方程式是
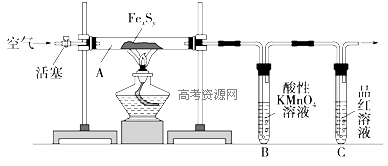
,反应④的化学方程式是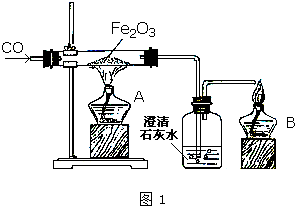 某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.
某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.
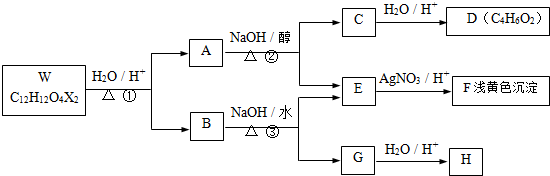
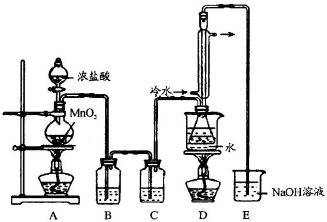 是工业上常用的硫化剂,实验室制备的方法有2种:
是工业上常用的硫化剂,实验室制备的方法有2种: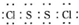 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下: