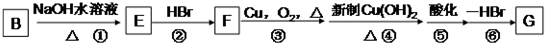题目内容
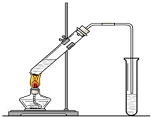
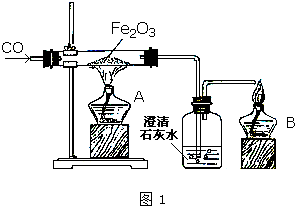 某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.
某研究性学习小组在用右图装置进行CO还原Fe2O3的探究实验.Ⅰ.实验过程
(1)气体验纯后开始进行实验,实验时应先点燃
Ⅱ.产物分析
他们发现生成的黑色粉末(以下用“X”表
示)可以全部被磁铁吸出,从而得出CO已经将Fe2O3全部还原成铁单质的结论.但乙同学认为黑色粉末X不一定是Fe.理由是有资料表明:CO与Fe2O3的反应因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引.为探究黑色粉末X的组成,乙同学进行了如下实验:
(一)定性检验
| 实验编号 | 实 验 操 作 | 实 验 现 象 |
| ① | 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热. | 黑色粉末逐渐溶解, 有无色气体逸出. |
| ② | 向试管1所得溶液中滴加几滴 KSCN溶液,振荡. | 溶液未出现血红色 |
(3)实验①中可能发生反应的离子方程式是
(二)定量测定
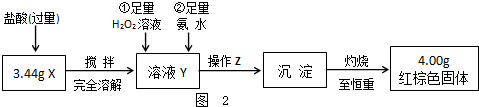
(4)如图2操作Z是
(5)通过以上数据,得出3.44g黑色粉末X中的成分(用化学式表示)及其物质的量分别是
考点:探究物质的组成或测量物质的含量,铁的氧化物和氢氧化物
专题:
分析:Ⅰ、(1)一氧化碳含有氧化铁,实验开始先点燃B处酒精灯,通一氧化碳气体,后点燃A处酒精灯加热氧化铁反应生成铁和二氧化碳;
Ⅱ、(2)有气体生成说明含有金属铁,黑色粉末X可能含有Fe,Fe3O4,向试管1所得溶液中滴加几滴KSCN溶液,振荡溶液未出现血红色说明不含铁离子,但不能说明固体不含Fe3O4,可能是铁和铁离子反应生成亚铁离子;
(3)实验①的反应可能是四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,铁和氢离子反应生成亚铁离子和氢气,铁和铁离子反应生成亚铁离子;
(4)X加入过量盐酸溶解加入足量过氧化氢氧化亚铜离子为铁离子,加入过量氨水溶液沉淀生成氢氧化铁,过滤洗涤得到氢氧化铁沉淀,灼烧至恒重得到4.00g红棕色固体为Fe2O3;灼烧固体需要在坩埚中进行,结合坩埚加热的实验操作选择仪器;
(5)依据铁元素守恒和极值计算分析判断.
Ⅱ、(2)有气体生成说明含有金属铁,黑色粉末X可能含有Fe,Fe3O4,向试管1所得溶液中滴加几滴KSCN溶液,振荡溶液未出现血红色说明不含铁离子,但不能说明固体不含Fe3O4,可能是铁和铁离子反应生成亚铁离子;
(3)实验①的反应可能是四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,铁和氢离子反应生成亚铁离子和氢气,铁和铁离子反应生成亚铁离子;
(4)X加入过量盐酸溶解加入足量过氧化氢氧化亚铜离子为铁离子,加入过量氨水溶液沉淀生成氢氧化铁,过滤洗涤得到氢氧化铁沉淀,灼烧至恒重得到4.00g红棕色固体为Fe2O3;灼烧固体需要在坩埚中进行,结合坩埚加热的实验操作选择仪器;
(5)依据铁元素守恒和极值计算分析判断.
解答:
解:Ⅰ、(1)一氧化碳含有氧化铁,实验开始先点燃B处酒精灯,通一氧化碳气体,防止含有空气点燃加热发生爆炸,后点燃A处酒精灯加热氧化铁反应生成铁和二氧化碳;
故答案为:B;
Ⅱ、(2)有气体生成说明含有金属铁,黑色粉末X可能含有Fe,Fe3O4,向试管1所得溶液中滴加几滴KSCN溶液,振荡溶液未出现血红色说明不含铁离子,但不能说明固体不含Fe3O4,可能是铁和铁离子反应生成亚铁离子后的结果,由上述实验现象推断,黑色粉末X的成分中不一定不含Fe3O4;
故答案为:否;
(3)实验①的反应可能是四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O;铁和氢离子反应生成亚铁离子和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑;铁和铁离子反应生成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O,Fe+2H+=Fe2++H2↑,Fe+2Fe3+=3Fe2+;
(4)X加入过量盐酸溶解加入足量过氧化氢氧化亚铜离子为铁离子,加入过量氨水溶液沉淀生成氢氧化铁,过滤洗涤得到氢氧化铁沉淀,灼烧至恒重得到4.00g红棕色固体为Fe2O3,操作Z是过滤洗涤;灼烧固体需要在坩埚中进行,结合坩埚加热的实验操作选择仪器为泥三角、三脚架、酒精灯;
故答案为:过滤;洗涤;坩埚;泥三角;
(5)4.0g红棕色固体为Fe2O3,物质的量=
=0.025mol,依据铁元素守恒得到n(Fe)=0.05mol,极值计算分析判断,若为铁质量为0.05mol×56g/mol=2.8g,若为Fe3O4质量=
×232g/mol=3.87g;得出3.44g黑色粉末X中的成分为:Fe3O4和Fe的混合物,设Fe3O4物质的量为x,Fe物质的量为y,则3x+y=0.05mol,232x+56y=3.44,x=0.010mol,y=0.020mol,其物质的量分别是Fe3O4 0.010mol,Fe 0.020mol;
故答案为:Fe3O4 0.010mol,Fe 0.020mol.
故答案为:B;
Ⅱ、(2)有气体生成说明含有金属铁,黑色粉末X可能含有Fe,Fe3O4,向试管1所得溶液中滴加几滴KSCN溶液,振荡溶液未出现血红色说明不含铁离子,但不能说明固体不含Fe3O4,可能是铁和铁离子反应生成亚铁离子后的结果,由上述实验现象推断,黑色粉末X的成分中不一定不含Fe3O4;
故答案为:否;
(3)实验①的反应可能是四氧化三铁和盐酸反应生成氯化亚铁、氯化铁和水,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O;铁和氢离子反应生成亚铁离子和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑;铁和铁离子反应生成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O,Fe+2H+=Fe2++H2↑,Fe+2Fe3+=3Fe2+;
(4)X加入过量盐酸溶解加入足量过氧化氢氧化亚铜离子为铁离子,加入过量氨水溶液沉淀生成氢氧化铁,过滤洗涤得到氢氧化铁沉淀,灼烧至恒重得到4.00g红棕色固体为Fe2O3,操作Z是过滤洗涤;灼烧固体需要在坩埚中进行,结合坩埚加热的实验操作选择仪器为泥三角、三脚架、酒精灯;
故答案为:过滤;洗涤;坩埚;泥三角;
(5)4.0g红棕色固体为Fe2O3,物质的量=
| 4.0g |
| 160g/mol |
| 0.05mol |
| 3 |
故答案为:Fe3O4 0.010mol,Fe 0.020mol.
点评:本题考查了物质组成探究实验和过程分析判断,主要是实验基本操作和物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是( )
| A、C1>C2 |
| B、C1=C2 |
| C、C1<C2 |
| D、2 C1=C2 |
下列有关说法正确的是( )
| A、将0.2mol/L的NH3?H2O与0.1mol/L的HCl溶液等体积混合后PH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | ||
| B、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32-),且C(Mg2+)?C(CO32-)═6.82×10-6 mol?L-1 | ||
C、0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:
| ||
| D、用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 |
短周期元素X、Y的原子序数相差2.下列有关叙述正确的是( )
| A、X与Y可能形成XY化合物 |
| B、X与Y一定位于同一周期 |
| C、X与Y不可能位于同一主族 |
| D、X与Y都为主族元素 |
下列离子方程式书写正确的是( )
| A、金属钠溶于水:2Na+2H2O=2Na++2OH-+H2↑ |
| B、Cl2与H2O反应:Cl2+H2O=2H++Cl-+ClO- |
| C、硫酸铜溶液与氢氧化钡溶液反应:Cu2++2OH-=Cu(OH)2↓ |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |

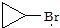 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有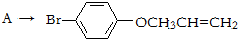 的有机反应类型:
的有机反应类型: