题目内容
对Fe(OH)3胶体和FeCl3溶液的比较,下列不正确的是( )
| A、可用丁达尔现象区别 |
| B、加入硫酸镁溶液前者会浑浊而后者无明显现象 |
| C、可用渗析的方法分离 |
| D、可用过滤的方法分离 |
考点:胶体的重要性质
专题:
分析:A.丁达尔现象是胶体的特性;
B.胶体遇电解质发生聚沉;
C.胶粒不能透过半透膜,溶液能透过;
D.胶体粒子和溶液的溶质都能通过滤纸.
B.胶体遇电解质发生聚沉;
C.胶粒不能透过半透膜,溶液能透过;
D.胶体粒子和溶液的溶质都能通过滤纸.
解答:
解:A.丁达尔现象是胶体所特有的现象,故A正确;
B.胶体中加入电解质溶液会出现聚沉现象,而溶液不会出现该现象,故B正确;
C.胶粒不能通过半透膜,所以用渗析的方法可以分离,故C正确;
D.胶体粒子和溶液的溶质都能通过滤纸,所以不能分离,故D错误.
故选D.
B.胶体中加入电解质溶液会出现聚沉现象,而溶液不会出现该现象,故B正确;
C.胶粒不能通过半透膜,所以用渗析的方法可以分离,故C正确;
D.胶体粒子和溶液的溶质都能通过滤纸,所以不能分离,故D错误.
故选D.
点评:本题考查了胶体的性质,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
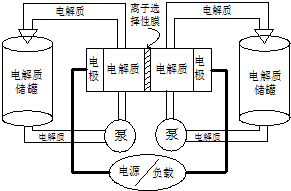 如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )
如图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr.下列说法正确的是( )| A、电池充电时,阳极电极反应式为:3Br--2e-=Br3- |
| B、电池放电时,负极电极反应式为:2S22-+2e-═S42- |
| C、电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3 |
| D、在充电过程中Na+通过膜的流向为从右到左 |
下列离子方程式书写正确的是( )
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
| C、碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
下列说法正确的是( )
| A、硅酸胶体通常带正电 |
| B、直径为1nm---100nm的微粒是胶体 |
| C、在标准状况下,1mol苯的体积约是22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |
下列说法正确是( )
| A、摩尔是物质的质量单位 |
| B、氧气的摩尔质量是32g |
| C、0.5mol氮气的体积为11.2L |
| D、1mol硫酸根的质量为96g |
相同体积的NaCl溶液(浓度为C1)和Na2SO4溶液(浓度为C2),若其中的Na+物质的量浓度相同,则它们的物质的量浓度C1和C2的关系是( )
| A、C1>C2 |
| B、C1=C2 |
| C、C1<C2 |
| D、2 C1=C2 |
某溶液中只含有大量的下列离子:Fe3+、NO3-、K+和M离子,经测定Fe3+、NO3-、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是下列中的( )
| A、Cl- |
| B、SO42- |
| C、Ca2+ |
| D、Na+ |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,0.3mol三氧化硫中含有氧原子数为0.9NA | ||
B、aL甲烷和乙烷混合气体中的分子数为
| ||
| C、5.6 g铁与足量氯气或硫蒸气反应转移的电子数为0.3 NA | ||
| D、1L 1mol/L醋酸溶液中离子总数为2NA |