题目内容
有机物A可用作果实催熟剂.某同学欲以A为主要原料合成乙酸乙酯,其合成路线如图所示.
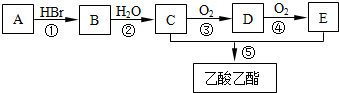
请回答:
(1)E的结构简式是 ,分子中含有的官能团名称是 .
(2)反应①的反应类型是 反应,反应①~⑤中反应类型与②相同的是 (填序号).
(3)由A可以直接转化为C,其反应的化学方程式是 .
(4)反应③的化学方程式是 ,反应④的化学方程式是 .
(5)写出与乙酸乙酯互为同分异构体且属于羧酸的结构简式 .

请回答:
(1)E的结构简式是
(2)反应①的反应类型是
(3)由A可以直接转化为C,其反应的化学方程式是
(4)反应③的化学方程式是
(5)写出与乙酸乙酯互为同分异构体且属于羧酸的结构简式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:C连续氧化得到E,二者反应得到CH3COOCH2CH3,则C为CH3CH2OH,E为CH3COOH,乙醇发生氧化反应生成D为CH3CHO,乙醛进一步发生氧化反应生成CH3COOH,有机物A可用作果实催熟剂,系列转化得到CH3CH2OH,故A为C2H4,与水发生加成反应得到B为CH3CH2Br,溴乙烷发生水解反应得到CH3CH2OH,据此解答.
解答:
解:C连续氧化得到E,二者反应得到CH3COOCH2CH3,则C为CH3CH2OH,E为CH3COOH,乙醇发生氧化反应生成D为CH3CHO,乙醛进一步发生氧化反应生成CH3COOH,有机物A可用作果实催熟剂,系列转化得到CH3CH2OH,故A为C2H4,与水发生加成反应得到B为CH3CH2Br,溴乙烷发生水解反应得到CH3CH2OH,
(1)E的结构简式是CH3COOH,分子中含有的官能团是羧基,故答案为:CH3COOH;羧基;
(2)反应①是乙烯与HBr发生加成反应,反应②⑤均属于取代反应,故答案为:加成反应;⑤;
(3)乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O
CH3CH2OH,
故答案为:CH2=CH2+H2O
CH3CH2OH;
(4)反应③是CH3CH2OH被氧化生成乙醛,反应方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,
反应④是乙醛氧化生成乙酸,反应方程式为:2CH3CHO+O2
2CH3COOH,
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;2CH3CHO+O2
2CH3COOH;
(5)与乙酸乙酯互为同分异构体且属于羧酸的结构简式有:CH3CH2CH2COOH、(CH3)2CHCOOH,故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH.
(1)E的结构简式是CH3COOH,分子中含有的官能团是羧基,故答案为:CH3COOH;羧基;
(2)反应①是乙烯与HBr发生加成反应,反应②⑤均属于取代反应,故答案为:加成反应;⑤;
(3)乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O
| 催化剂 |
故答案为:CH2=CH2+H2O
| 催化剂 |
(4)反应③是CH3CH2OH被氧化生成乙醛,反应方程式为:2CH3CH2OH+O2
| Cu |
| △ |
反应④是乙醛氧化生成乙酸,反应方程式为:2CH3CHO+O2
| 催化剂 |
故答案为:2CH3CH2OH+O2
| Cu |
| △ |
| 催化剂 |
(5)与乙酸乙酯互为同分异构体且属于羧酸的结构简式有:CH3CH2CH2COOH、(CH3)2CHCOOH,故答案为:CH3CH2CH2COOH、(CH3)2CHCOOH.
点评:本题考查有机物推断,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、实验室用大理石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O |
| C、碳酸钡溶于稀硝酸:BaCO3+2H+=Ba2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
某溶液中只含有大量的下列离子:Fe3+、NO3-、K+和M离子,经测定Fe3+、NO3-、K+和M离子的物质的量之比为2:5:1:1,则M离子可能是下列中的( )
| A、Cl- |
| B、SO42- |
| C、Ca2+ |
| D、Na+ |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,0.3mol三氧化硫中含有氧原子数为0.9NA | ||
B、aL甲烷和乙烷混合气体中的分子数为
| ||
| C、5.6 g铁与足量氯气或硫蒸气反应转移的电子数为0.3 NA | ||
| D、1L 1mol/L醋酸溶液中离子总数为2NA |
下列有关说法正确的是( )
| A、将0.2mol/L的NH3?H2O与0.1mol/L的HCl溶液等体积混合后PH>7,则c(Cl-)>c(NH4+)>c(OH-)>c(H+) | ||
| B、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有C(Mg2+)=C(CO32-),且C(Mg2+)?C(CO32-)═6.82×10-6 mol?L-1 | ||
C、0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:
| ||
| D、用惰性电极电解Na2SO4溶液,阳阴两极产物的物质的量之比为2:1 |
在一体积固定的密闭 容器中,进行化学反应:2X(g)+Y(s)?Z(g)+W(g),若其化学平衡常数(K)和温度(℃)的关系如下表:对该反应而言,下列说法正确的是( )
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.3 | 1.8 | 2.7 |
| A、该反应正反应为放热反应 |
| B、K越大,反应物的转化率越大 |
| C、温度不变,增加X的用量,K增大 |
| D、达平衡后,加入催化剂,平衡向正反应方向移动 |
