题目内容
10.某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去.为研究其组成,某小组同学进行了如图实验.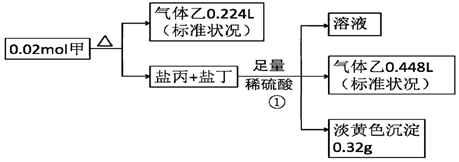
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定.
(1)气体乙的化学式SO2,写出 ①中产生淡黄色沉淀的反应的离子反应方程式S2O32-+2H+═S↓+SO2↑+H2O
(2)甲可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.1mol甲,理论上可以除去Cr2O72-的物质的量为0.1mol.
分析 甲的焰色为黄色,含有Na元素,盐丙和丁的组成元素和甲相同,加入足量硫酸反应生成的乙能使品红溶液褪色,则乙为SO2,生成的淡黄色沉淀为S,丙、丁中其中一种为Na2S2O3,发生反应:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,反应①生成的二氧化硫为$\frac{0.448L}{22.4L/mol}$=0.02mol,硫为$\frac{0.32g}{32g/mol}$=0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3,发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol-0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到二氧化硫为$\frac{0.224L}{22.4L/mol}$=0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4,据此解答.
解答 解:(1)乙为二氧化硫,能与品红结合生成不稳定的无色化合物,使品红溶液褪色,①中产生黄色沉淀的反应的离子反应方程式:S2O32-+2H+=S↓+SO2↑+H2O,
故答案为:SO2 ;S2O32-+2H+=S↓+SO2↑+H2O;
(2)甲的化学式为Na2S2O4,甲可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+),S2O42-+Cr2O72-+6H+=2Cr3++3H2O+2SO42-,则每消耗0.1mol甲,理论上可以除去Cr2O72-的物质的量为0.1mol,
故答案为:0.1;
点评 本题考查无机物推断,属于计算型推断,关键是根据气体乙的性质及淡黄色沉淀判断丙、丁其中一种为Na2S2O3,需要学生具备扎实的基础,题目难度较大.

| A. | 向平衡体系中加入水,平衡正向移动,c (H+)增大 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 向水中加入少量硫酸氢钠固体,$\frac{c({H}^{+})}{c(O{H}^{-})}$增大 | |
| D. | 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低 |
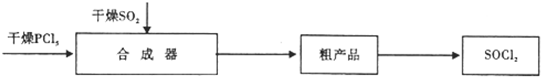
已知:合成器中发生的反应为:PCl5(熔融)+SO2$\frac{\underline{\;一定温度\;}}{\;}$SOCl2+POCl3△H<0 (POCl3 的沸点为105.3℃)
请回答下列问题:
(1)要得到干燥的SO2气体,可将潮湿的SO2通过装有AD的干燥装置(填写字母番号,多选).
A.浓硫酸B.生石灰C.氢氧化钠D.硅胶
(2)工业上从粗产品中,可采用分馏(或蒸馏)的方法(填写操作方法)获得较纯的SOCl2.
(3)合成器的内层,最好选用耐高温、耐氧化、耐腐蚀(工程陶瓷或耐高温陶瓷)材料制成.
(4)已知SOCl2与H2OI发生剧烈反应,有白雾形成并逸出有剌激性气味的气体,请写出该 反应的化学方程式SOCl2+H2O=SO2↑+HCl↑.
(5)SOCl2已Li-SOCl2电池,其电极材料分别为锂和碳,电解液是LiAlCl-SOCl2.电池的总反应可表示为:Li+SOCl2═4LiCl+S+SO2.该电池的负极的电极反应式为Li-e-=Li+
(6)某学习小组用刚吸收过少量SO2的NaOH溶液吸收SOOl2加热分解并冷却至室温后 的气体.吸收一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO${\;}_{4}^{2-}$.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响).
①提出合理假设.
假设1:只存在SO${\;}_{3}^{2-}$;假设2:既不存在SO${\;}_{3}^{2-}$也不存在ClO-;假设3:只存在ClO-.
②设计实验方案,进行实验.请写出实验步骤以及预期现象和结论.限选实验试剂:3moL.L-1H2SO4溶液、1moL.L-1NaOH溶液、0.1moL.L-1KMnO4溶液、淀粉一KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1取少量吸收液于试管中滴加3moL.L-1H2SO4,至溶液呈酸性,然后将所得溶液分置于A、B试管中. | 无明显现象 |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后褪色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,否则无 |
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 4.7 | 3.4 |
| 沉淀完全的pH | 3.2 | 6.7 | 4.7 |
| A. | 该温度下Ksp[Fe(OH)3]=1×10-14.6 | |
| B. | W主要含有 Cu(OH)2和Al(OH)3 | |
| C. | 溶液X中一定含有Cu2+、Fe3+和SO42- | |
| D. | 取溶液Y进行焰色反应,可判断溶液X中是否含有Na+ |
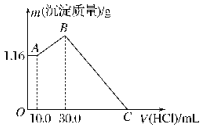 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
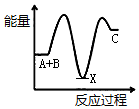
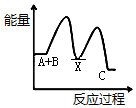
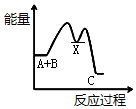
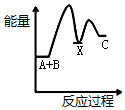
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得溶液中逐滴加入1.00mol•L-1HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答: 已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题.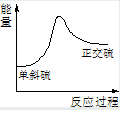
 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
 、
、 .
.