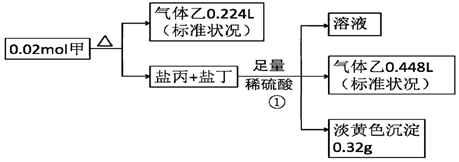
题目内容
19.元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元 素①-⑩在表中的位置回答下列问题.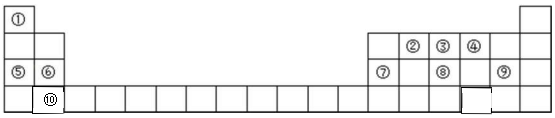
(1)在这 10 种元素中,原子半径最大的是 Ca (填元素符号).
(2)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是HClO4>H3PO4.(填化学式)
(3)写出⑨形成的单质和水反应的离子方程式Cl2+H2O=H++Cl-+HClO.
(4)写出①、④元素组成的化合物的电子式是
 、
、 .
.(5)④⑤⑥⑦对应的离子半径最小的是Al3+(填离子符号).
(6)写出实验室制取③的气态氢化物的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
分析 由元素为周期表的位置可知,①-⑩分别为H、C、N、O、Na、Mg、Al、P、Cl、Ca,
(1)电子层越多,原子半径越大;
(2)非金属性越强,对应最高价含氧酸的酸性越强;
(3)氯气与水反应生成盐酸和次氯酸;
(4)①、④元素组成的化合物为H2O或H2O2;
(5)具有相同电子排布的离子中,原子序数大的离子半径小;
(6)铵盐与碱共热制备氨气.
解答 解:由元素为周期表的位置可知,①-⑩分别为H、C、N、O、Na、Mg、Al、P、Cl、Ca,
(1)电子层越多,原子半径越大,则在这 10 种元素中,原子半径最大的是Ca,故答案为:Ca;
(2)非金属性越强,对应最高价含氧酸的酸性越强,⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是HClO4>H3PO4,
故答案为:HClO4;H3PO4;
(3)氯气与水反应生成盐酸和次氯酸,反应为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO;
(4)①、④元素组成的化合物为H2O或H2O2,电子式分别为 、
、 ,故答案为:
,故答案为: ;
; ;
;
(5)具有相同电子排布的离子中,原子序数大的离子半径小,则④⑤⑥⑦对应的离子半径最小的是Al3+,故答案为:Al3+;
(6)实验室制取③的气态氢化物的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素元素在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量最多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物均有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
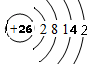
(1)A在元素周期表中的位置是第二周期,第ⅣA族;F的原子结构示意图是
 ;
;(2)下列事实能证明C和E的非金属性强弱的是②③.(填序号)
①常温下,C的单质呈气态,E的单质呈固态②C的气态氢化物的稳定性强于E的气态氢化物的稳定性③C与E形成的化合物中,E呈正价④E的氢化物的沸点高于C的氢化物的沸点
(3)由A、B、C和氢元素四种元素所形成的阴、阳离子数目之比为1:1的离子化合物是NH4HCO3(填化学式),它与足量NaOH溶液在加热时反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O.
(4)A的氢化物有多种,1 molA的某种氢化物分子中含有14mol电子,请写出该氢化物的电子式:
 ,
,已知在25℃,101KPa下,1g该氢化物在足量氧气中完全燃烧生成液态水时放出的热量为40kJ,写出该氢化物燃烧热:1040kJ/mol.
Ⅱ、甲、乙、丙、丁均为上述元素所形成的物质,甲是单质,它们之间有如下的反应关系:
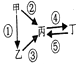
(1)若乙为淡黄色固体,②③反应均用到同一种液态氢化物,丁物质常用于食品工业,乙所含化学键的类型是离子键和共价键.写出乙→丙的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(2)若丁物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出丙→丁的离子方程式:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.室温下,若由丁物质形成的水溶液中甲离子浓度为1.3×10-6 mol•L-1,则该溶液的pH为5.(丁的Ksp为1.3×10-33)
| 元素 | 相 关 信 息 |
| A | 原子核外有7种运动状态不同的电子 |
| B | 外围电子排布式为nsnnpn+2 |
| C | 常见的金属,在周期表中周期序数与族序数相等 |
| D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
| E | 一种核素的质量数为56,中子数为30 |
| F | 单质紫红色,电缆材料,常见氧化物为黑色 |
(1)元素E在元素周期表中的位于第四周期第Ⅷ族,其高价态离子核外有5个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是r(Al3+)<r(O2-)<r(C1-)(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为
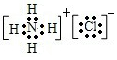
(4)常温下AD3是一种淡黄色液体.以下关于AD3的说法中,正确的是BC
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是蓝色溶液先产生蓝色沉淀,最后沉淀溶解,形成深蓝色溶液;该过程总的离子反应式为Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4 NH3•H2O=[Cu(NH3)4]2++4H2O向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是C
A.配位键 B.极性共价键 C.非极性共价键 D.离子键.
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
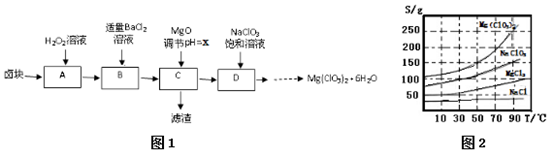
已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
②室温时一些物质的Ksp如表:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
(1)H2O2的电子式为
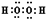
(2)滤渣的成分是Fe(OH)3、BaSO4(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为3.3
(4)D中所发生的化学反应方程式式为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,框图中由D→…→制Mg(ClO3)2•6H2O晶体的实验步骤依次为:①加热蒸发;②趁热过滤(请补充);③冷却结晶;④过滤洗涤.
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10.00mL试液于锥形瓶中,加入10.00mL稀硫酸和20.00mL 1.000mol/L的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点.
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果偏小(填“偏大”.“偏小”或“不变”).
③若平均消耗K2Cr2O7溶液15.00mL,则产品中Mg(ClO3)2•6H2O(其M=299g/mol)的质量分数为78.3%.
| A. | 硫酸钠 | B. | 乙酸 | C. | 氯化镁 | D. | 二氧化碳 |
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 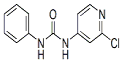 | 白色结晶粉末 | 170~172°C | 易溶于水 |
(2)氯吡苯脲的晶体类型为分子晶体.该分子是由极性、非极性键形成的极性分子(填“极性”或“非极性”)