题目内容
已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如表.
请根据信息回答有关问题:
(1)C元素在周期表中的位置为 ,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键 .
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为 ,氧原子杂化类型与下列分子的中心原子杂化类型相同的是
a.CO2 b.SO2 c.NH3 d.CH4
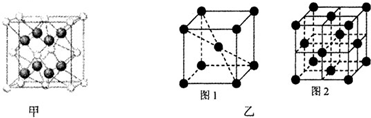
(4)A、B可形成离子化合物,其晶胞结构如图甲所示,则晶胞中B离子的个数为 ,与B离子最近且等距的A离子的个数为 .
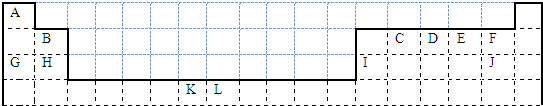
(5)1183K以下C晶体的晶胞如图乙中图1,而1183K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为 (可用根号表示).
| 元素 | 结构或性质信息 |
| A | 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B | 原子核外M层电子数是N层电子数的4倍 |
| C | 是使用最为广泛的合金的主要成分 |
| D | 原子各内层电子均已饱和,最外层电子数为1 |
(1)C元素在周期表中的位置为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为
a.CO2 b.SO2 c.NH3 d.CH4
(4)A、B可形成离子化合物,其晶胞结构如图甲所示,则晶胞中B离子的个数为
(5)1183K以下C晶体的晶胞如图乙中图1,而1183K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为

考点:晶胞的计算,位置结构性质的相互关系应用
专题:
分析:原子核外有一个未成对电子,其氢化物与水分子间能形成氢键,则A为F;
原子核外M层电子数是N层电子数的4倍,M层为8个电子,N层为2个电子,则B为Mg;
是使用最为广泛的合金的主要成分是铁,则C为Fe;
原子各内层电子均已饱和,最外层电子数为1,且原于序数大于Fe,则D为Cu,以此分析.
原子核外M层电子数是N层电子数的4倍,M层为8个电子,N层为2个电子,则B为Mg;
是使用最为广泛的合金的主要成分是铁,则C为Fe;
原子各内层电子均已饱和,最外层电子数为1,且原于序数大于Fe,则D为Cu,以此分析.
解答:
解:原子核外有一个未成对电子,其氢化物与水分子间能形成氢键,则A为F;
原子核外M层电子数是N层电子数的4倍,M层为8个电子,N层为2个电子,则B为Mg;
是使用最为广泛的合金的主要成分是铁,则C为Fe;
原子各内层电子均已饱和,最外层电子数为1,且原于序数大于Fe,则D为Cu,
(1)Fe位于元素周期表的第四周期,第Ⅷ族,Cu原子的外围电子排布式为3d104s1,
故答案为:第四周期Ⅷ族;3d104s1;
(2)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(3)F与氧可形成原子个数比为2:1的三原子分子OF2,F的电负性大于O,因此F为-1价,O为+2价,O的价层电子对数为2+
(6-2×1)=4,杂化类型为sp3,
a、CO2中C原子含有2个σ键,不含孤电子对,所以C原子采用sp杂化;
b、SO2中S原子含有2个σ键,含1个孤电子对,所以S原子采取sp2杂化;
c、NH3中价层电子对个数=3+
(5-3×1)=4,所以N原子采用sp3杂化;
d、CH4中价层电子对个数=4+
×(4-4×1)=4,所以C原子采用sp3杂化;
故答案为:+2;cd;
(4)A、B可形成离子化合物是MgF2,由晶胞结构可知,白代表镁离子,镁离子的个数为8×
+6×
=4,黑球为F-,个数为8×1=8,由面心的镁离子可以看出与镁离子最近且等距的F-的个数为4×2=8,
故答案为:4;8;
(5)图1为体心立方晶胞,原子的空间利用率为68%,图2为面心立方晶胞,原子的空间利用率为74%,则图1、图2所示两种晶中原子的空间利用率之比为68%:74%,
故答案为:68%:74%.
原子核外M层电子数是N层电子数的4倍,M层为8个电子,N层为2个电子,则B为Mg;
是使用最为广泛的合金的主要成分是铁,则C为Fe;
原子各内层电子均已饱和,最外层电子数为1,且原于序数大于Fe,则D为Cu,
(1)Fe位于元素周期表的第四周期,第Ⅷ族,Cu原子的外围电子排布式为3d104s1,
故答案为:第四周期Ⅷ族;3d104s1;
(2)HF水溶液中存在的所有氢键为:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(3)F与氧可形成原子个数比为2:1的三原子分子OF2,F的电负性大于O,因此F为-1价,O为+2价,O的价层电子对数为2+
| 1 |
| 2 |
a、CO2中C原子含有2个σ键,不含孤电子对,所以C原子采用sp杂化;
b、SO2中S原子含有2个σ键,含1个孤电子对,所以S原子采取sp2杂化;
c、NH3中价层电子对个数=3+
| 1 |
| 2 |
d、CH4中价层电子对个数=4+
| 1 |
| 2 |
故答案为:+2;cd;
(4)A、B可形成离子化合物是MgF2,由晶胞结构可知,白代表镁离子,镁离子的个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4;8;
(5)图1为体心立方晶胞,原子的空间利用率为68%,图2为面心立方晶胞,原子的空间利用率为74%,则图1、图2所示两种晶中原子的空间利用率之比为68%:74%,
故答案为:68%:74%.
点评:本题考查了元素位-构-性的关系,涉及元素推断、核外电子排布、氢键、杂化类型、晶胞的计算等知识点,综合性较强,难度较大,元素推断为解题的前提,熟练掌握物质结构与性质的核心知识是解题的根本,注意不同堆积空间利用率的数值的记忆.

练习册系列答案
相关题目
下列实验误差分析错误的是( )
| A、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D、测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
下列四组实验,根据实验事实得出的结论,正确的是( )
| A、在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解,则原未知试液中一定含有S042- |
| B、在某试液中滴加NaOH溶液得白色沉淀,继续滴加该白色沉淀溶解,则原未知试液中一定含有Al3+ |
| C、在未知试液中滴加盐酸产生无色气体,将该气体通入过量澄清石灰水中得白色沉淀,则原未知试液中一定含有C032- |
| D、某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是S02 |
已知:可逆反应2SO2(g)+O2(g)?2SO3(g)△H<0,在一定条件下达到平衡后,改变下列条件能使该平衡向正反应方向移动的是( )
| A、升温增压 | B、降温增压 |
| C、升温减压 | D、降温减压 |


 乙酸是食醋的主要成分,它具有以下化学性质:
乙酸是食醋的主要成分,它具有以下化学性质: