题目内容
12.二茂铁可用作燃料的节能消烟剂、抗爆剂等.实验室制备二茂铁装置示意图如下: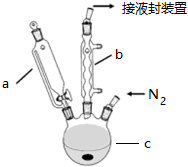
实验原理为:
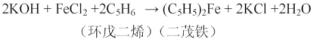
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min.
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(密度0.95g/cm3),搅拌.
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜)配成的溶液25ml装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min.
④再从仪器a加入25mL无水乙醚搅拌.
⑤将c中的液体转入仪器d,依次用盐酸、水各洗涤两次,分液得橙黄色溶液.
⑥蒸发橙黄色溶液,得二茂铁粗产品.
⑦…
回答下列问题:
(1)步骤①中通入氮气的目的是:排尽装置中空气,防止实验过程中亚铁离子被氧化.
(2)仪器c的名称为:三颈烧瓶,其适宜容积应为:b.
a.100ml b.250ml c.500ml
(3)仪器d使用前应进行的操作是:检漏,请简述该过程:关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞是否漏水,若不漏水,关闭上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水.
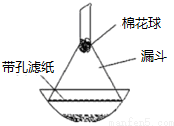
(4)步骤⑦是二茂铁粗产品的提纯,该过程在下图中进行,其操作名称为:升华.
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是测定所得固体的熔点.
(6)最终得到纯净的二茂铁3.7g,则该实验的产率为50%(保留两位有效数字).
分析 (1)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气;
(2)根据仪器的结构可知仪器c为三颈烧瓶;三颈烧瓶中盛放液体的体积不超过容积的$\frac{2}{3}$分析判断;
(3)仪器d为分液漏斗,分液漏斗检验是否漏水需要检验两处活塞是否漏水;
(4)二茂铁有固体直接变成气体,然后冷凝收集,称为升华;
(5)可以通过测定所得固体的熔点确定;
(6)根据戊二烯计算二茂铁的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)二茂铁中铁是+2价,易被空气中氧气氧化,通入氮气排尽装置中空气,防止实验过程中亚铁离子被氧化,
故答案为:排尽装置中空气,防止实验过程中亚铁离子被氧化;
(2)仪器c为三颈烧瓶,由题意可知共加入液体110mL,三颈烧瓶中盛放液体的体积不超过容积的$\frac{2}{3}$,所以选择250ml;
故答案为:三颈烧瓶;b;
(3)分液漏斗使用前应进行的操作是:检漏,具体过程:关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞是否漏水,若不漏水,关闭上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水;
故答案为:检漏;关闭分液漏斗颈部旋塞,向分液漏斗内注入适量的蒸馏水,观察旋塞是否漏水,若不漏水,关闭上磨口塞,倒立,检查是否漏水;若不漏水,正立,将上磨口塞旋转180度,倒立,检查是否漏水;
(4)二茂铁有固体直接变成气体,然后冷凝收集,其操作名称为升华;
故答案为:升华;
(5)为了确证得到的是二茂铁,还需要进行的一项简单实验是测定所得固体的熔点;
故答案为:测定所得固体的熔点;
(6)二茂铁的理论产量为$\frac{5.5mL×0.95g/cm{\;}^{3}}{66g/mol}$×$\frac{1}{2}$×186g/mol=7.4g,则产率=$\frac{3.7g}{7.4g}$×100%=50%;
故答案为:50%.
点评 本题以二茂铁的制备实验为载体考查常见仪器的识别,实验方案的分析、评价,化学实验基本操作,物质的分离、提纯和检验,物质结构的测定.

 阅读快车系列答案
阅读快车系列答案| A. | 二氧化碳 碳酸钠 | B. | 硫酸钠 乙醇 | ||
| C. | 氧化铝 硫 | D. | 盐酸 蔗糖 |
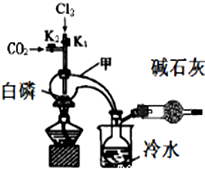 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.已知:白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;PCl3遇O2会生成POCl3(三氯氧磷);POCl3能溶于PCl3;POCl3和PCl3遇水会强烈水解.实验室制取PCl3的装置示意图和有关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
(1)实验所需氯气可用MnO2和浓HCl反应制取,实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶、分液漏斗.制取的氯气需要进行干燥,请设计实验证明通入的氯气是干燥的将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可);(写出操作、现象、结论).
(2)实验过程中要加入白磷、通入CO2、通入Cl2、加热,实验时具体的操作方法和顺序是在甲中先加入白磷,再通入CO2到排尽甲中的空气,向甲中通入Cl2,加热.
(3)E烧杯中加入冷水的目的是冷却PCl3,使其液化,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气.
(4)实验制得的粗产品中常含有POCl3、PCl5等,先加入过量白磷加热,除去PCl5和过量白磷后,再除去PCl3中的POCl3制备纯净的PCl3可选用的方法有C(填字母序号).
A.萃取 B.过滤 C.蒸馏 D.蒸发结晶
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,则PCl3和水反应后所得溶液中除OH-之外其它离子的浓度由大到小的顺序是c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-)
(已知亚磷酸(H3PO3)是二元弱酸).
②若将0.01 mol POCl3投入热水配成1 L的溶液,再逐滴加入AgNO3溶液,则先产生的沉淀是AgCl[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
 )原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)原料,制取苯甲酸甲酯,已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g•cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)浓硫酸的作用是催化剂、吸水性;
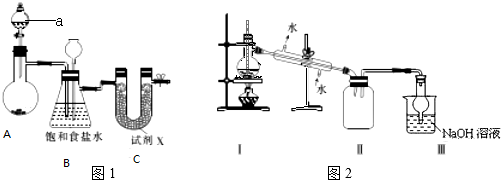
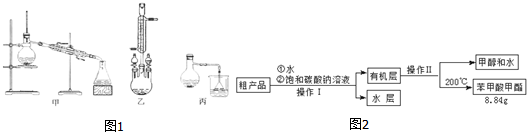
(2)甲和乙两位同学分别设计了如图1所示的两套实验室合成苯甲酸甲酯的装置 (夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙(填“甲”或“乙”或“丙”)装置.
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图2中方括号内填入操作方法的名称.操作I分液操作Ⅱ蒸馏
(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”)并简述原因NaOH是强碱,使苯甲酸甲酯水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率为65%.
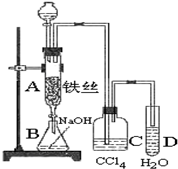 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.