题目内容
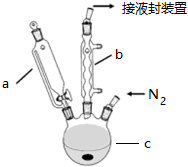
20.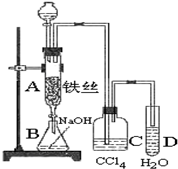 实验室用图装置制取少量溴苯,试填写下列空白.
实验室用图装置制取少量溴苯,试填写下列空白.(1)分液漏斗中装的试剂是苯、溴.
(2)B中氢氧化钠的作用:吸收溴单质,与溴苯分层.
(3)应完毕后,向试管D中滴加AgNO3溶液有淡黄色沉淀生成,此现象说明这种获得溴苯的反应属于:取代反应.(填有机反应类型)
(4)C中盛放的四氯化碳的作用吸收HBr中的溴蒸气.
(5)纯溴苯为无色液体,它比水重(轻或重).
(6)请你分析D中导管的下口可否浸没于液面中?为什么?不能,导管口在液面下可发生倒吸.
分析 由溴苯制备实验装置可知,苯与溴在三溴化铁为催化剂时发生取代反应生成溴苯,反应的化学方程式为 ,B中NaOH吸收溴,与溴苯分层,C中四氯化碳吸收HBr中的溴单质,D中HBr溶于水,与硝酸银反应生成AgBr沉淀,D中导管在液面上,可防止倒吸,以此来解答.
,B中NaOH吸收溴,与溴苯分层,C中四氯化碳吸收HBr中的溴单质,D中HBr溶于水,与硝酸银反应生成AgBr沉淀,D中导管在液面上,可防止倒吸,以此来解答.
解答 解:(1)由图可知,分液漏斗中装的试剂是苯、溴,故答案为:苯;溴;
(2)B中氢氧化钠的作用为吸收溴单质,与溴苯分层,故答案为:吸收溴单质,与溴苯分层;
(3)应完毕后,D中HBr溶于水,向试管D中滴加AgNO3溶液有淡黄色沉淀生成,此现象说明这种获得溴苯的反应属于取代反应,故答案为:淡黄色沉淀;取代反应;
(4)溴易溶于四氯化碳,不易溶于水,则C中盛放的四氯化碳的作用吸收HBr中的溴蒸气,故答案为:吸收HBr中的溴蒸气;
(5)纯溴苯为无色液体,它比水重,故答案为:无;重;
(6)因HBr极易溶于水,则D中导管的下口不能浸没于液面中,否则易发生倒吸,故答案为:不能,导管口在液面下可发生倒吸.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、有机物的性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意有机反应及混合物分离提纯的应用,题目难度不大.

练习册系列答案
相关题目
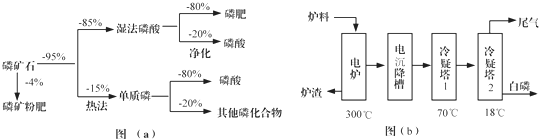
5.磷矿石主要以磷酸钙[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:
部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
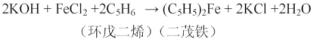
 亚硝酸钠可大量用于染料和有机合成工业.
亚硝酸钠可大量用于染料和有机合成工业.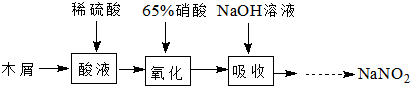
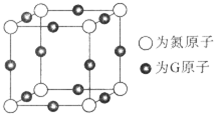 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都 是2;B、C、D同周期;E核外的s、p能级的电子总数相;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答下列问题:(相关问题用元素符号表示)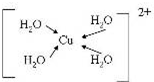 (配位键用→标出).
(配位键用→标出).