题目内容
17.四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2.实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气.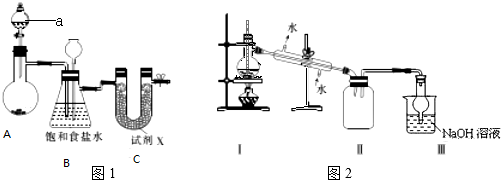
Ⅰ.图1示实验室制备干燥氯气的实验装置(夹持装置己略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,A中发生反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有安全瓶防止倒吸作用.
(3)试剂X可能为AD(填写字母).
A.无水氯化钙 B.浓硫酸 C.碱石灰 D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式SnCl4+2H2O=SnO2+4HCl.
(5)用锡花代替锡粒的目的是增大与氯气的接触面积,加快反应速率.
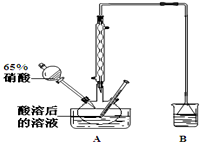
II.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是温度计水银球位置不对、;Ⅱ和Ⅲ之间缺少干燥装置.
(7)实验用的锡花中含有金属铜.甲同学设计下列实验测定锡花的纯度.
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用1.000mol/LK2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为(未配平):Fe2++Cr2O72-+H+→Cr3++Fe3++H2O
若达到滴定终点时共消耗20.00mlK2Cr2O7溶液,试计算锡花中锡的百分含量95.2%(结果保留三位有效数字).
分析 仪器a为分液漏斗;Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水;制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若D中发生堵塞,装置内气压增大,c中食盐水会被压入长颈漏斗中;四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过,
Ⅰ.(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水;
(2)制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若C中发生堵塞,装置内气压增大,B中食盐水会被压入长颈漏斗中;
(3)四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过;
(4)四氯化锡遇水强烈水解,根据水解原理可知,应生成Sn(OH)4、HCl,产物之一是固态二氧化锡,说明Sn(OH)4分解生成SnO2与H2O,故水解生成SnO2、HCl;
(5)增大与氯气的接触面积,加快反应速率;
Ⅱ.蒸馏装置应通过温度计控制温度;四氧化锡(SnCl4)在潮湿的空气中易水解,必须防止水的进入,该装置汇总有两处不合理之处,它们分别是缺少温度计;Ⅱ和Ⅲ之间缺少干燥装置;收集的SnCl4中混有氯气,氯气有毒,可通过氢氧化钠溶液吸收;
(6)温度计水银球位置不对;四氯化锡遇水强烈水解,而装置Ⅲ中的水蒸气易进入Ⅱ中,使其发生水解;
(7)过量FeCl3,将Sn2+氧化成Sn4+,本身被还原为亚铁离子,结合原子守恒和电荷守恒写出离子方程式;根据n=cV计算反应中消耗的K2Cr2O7的物质的量;根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,据此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:Ⅰ.(1)A中Ca(ClO)2和浓盐酸反应生成氯化钙、氯气与水,反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,
故答案为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
(2)制备的氯气中含有HCl,饱和食盐水除去Cl2中的HCl;若C中发生堵塞,装置内气压增大,B中长颈漏斗中液面上升,形成水柱,防止倒吸起到安全瓶的作用,
故答案为:安全瓶防止倒吸;
(3)四氯化锡极易水解,通入的氯气应干燥,U形管中试剂X干燥氯气,不能为碱性干燥剂,可以吸收氯气,不能为液体干燥剂,否则气体不能通过,可以选择氯化钙、五氧化二磷,
故答案为:AD;
(4)四氯化锡遇水强烈水解,根据水解原理可知,应生成Sn(OH)4、HCl,产物之一是固态二氧化锡,说明Sn(OH)4分解生成SnO2与H2O,故水解生成SnO2、HCl,反应方程式为:SnCl4+2H2O=SnO2+4HCl,
故答案为:SnCl4+2H2O=SnO2+4HCl;
(5)用锡花代替锡粒的目的是:增大与氯气的接触面积,加快反应速率,
故答案为:增大与氯气的接触面积,加快反应速率;
Ⅱ.(6)温度计水银球位置不对,应再蒸馏烧瓶支管口处;四氯化锡遇水强烈水解,而装置Ⅲ中的水蒸气易进入Ⅱ中,使其发生水解,二者之间缺少干燥装置;
故答案为:温度计水银球位置不对;Ⅱ和Ⅲ之间缺少干燥装置;
(7)第二步:过量FeCl3,将Sn2+氧化成Sn4+,本身被还原为亚铁离子,反应的离子方程式为:2Fe3++Sn2+=2Fe2++Sn4+,反应中消耗的K2Cr2O7的物质的量为1.0mol/L×0.020L=0.02mol,
根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
故n(Sn)=3n(K2Cr2O7)=3×0.02mol=0.06mol,
Sn的质量为:0.06mol×119g/mol=7.14g,
试样中Sn的百分含量为$\frac{7.14\\;g}{7.5g}$×100%=95.2%,
故答案为:95.2%;
点评 本题考查实验探究和物质制备方法和过程分析,氧化还原反应滴定的计算,题目难度中等,注意利用关系式计算的计算.

| A. | NH4C1溶液因水解而显酸性,故NH4C1是弱电解质 | |
| B. | 纯碱溶液因水解而显碱性,水解的离子方程式为:CO32-+H2O?H2CO3+2OH- | |
| C. | 可乐因含碳酸而显酸性,电离方程式为:H2CO3?CO32-+2H+ | |
| D. | 配制FeC13 溶液时,先将FeC13 溶于较浓的盐酸中,然后再加水稀释到所需浓度 |
部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
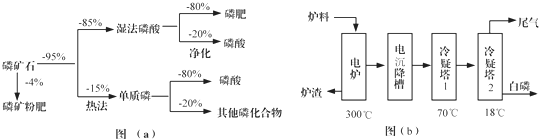
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是CaSiO3(填化学式).冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3.(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g) 放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g) 放出能量 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
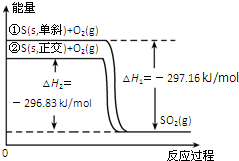
| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
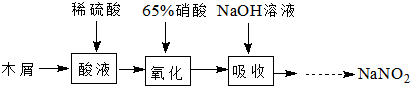
 亚硝酸钠可大量用于染料和有机合成工业.
亚硝酸钠可大量用于染料和有机合成工业.