题目内容
7.已知同一个碳原子上连接两个羟基的结构不稳定,易转变成醛基,不与钠反应.分子式为C4H10O2,能与钠反应产生氢气的同分异构体共有(不考虑立体异构)( )| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
分析 分子式为C4H10O2,能与钠反应产生氢气,说明分子中含有2个羟基或1个羟基和1个醚键,含有2个羟基时可以看成C4H10中的2个氢原子被2个羟基取代,且1个碳原子上不能连接2个羟基,采用定1移2法确定丁烷的二元取代产物;含有1个羟基时,先确定醚的结构,再用羟基取代确定一元取代产物来解答.
解答 解:分子式为C4H10O2,能与钠反应产生氢气,说明分子中含有2个羟基或1个羟基和1个醚键,
含有2个羟基时可以看成C4H10中的2个氢原子被2个羟基取代,且1个碳原子上不能连接2个羟基,C4H8(OH)2的同分异构体可以采取“定一议二”法确定:

 ,故C4H8(OH)2共有6种;
,故C4H8(OH)2共有6种;
含有1个羟基时,C4H10O作为醚时有4种:CH3OCH2CH2CH3,CH3CH2OCH2CH3,CH3OCH(CH3)2,醚键相连的2个碳原子上没有羟基,用羟基取代,可得到产物有4种,所以符合条件的产物有10种,
故选C.
点评 本题考查同分异构体的书写,题目难度不大,注意二元取代物可采用定1议2法解题.

练习册系列答案
相关题目
4.工业上常用铁质容器盛装冷浓硫酸,为研究铁材料与热浓硫酸的反应,某学习小组称取铁钉6.0g放入15.0mL浓硫酸中,加热.充分反应后得到溶液X并收集到气体Y.甲同学认为X中除含Fe3+外还可能含有Fe2+.若要确认其中Fe2+,应选用( )
| A. | KSCN溶液和氯水 | B. | 铁粉和KSCN溶液 | C. | 浓氨水 | D. | 酸性KMnO4溶液 |
5.化学反应原理模块中涉及很多常数,下列说法中不正确的是( )
| A. | 对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 | |
| B. | 化学反应速率常数k与浓度无关,但受温度、催化剂、固体表面性质等因素的影响 | |
| C. | 水的离子积常数Kw、电离平衡常数Ka与温度有关,不受溶液的酸碱性影响 | |
| D. | 溶度积常数Ksp与难溶电解质的性质和温度无关,只与沉淀的量有关 |
19.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得. 已知:Na2S2O3在酸性溶液中不能稳定存在.
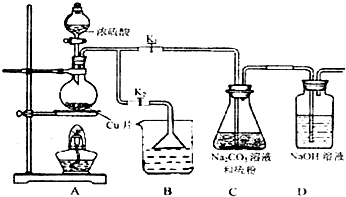
(1)某研究小组设计了制备Na2S203•5H20装置和部分操作步骤如下.
I.打开K1关闭K2,向圆底 烧瓶中加入足量浓硫酸加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品Na2S203.5H20.
回答下列问题:
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因S2O32-+2H+═S↓+SO2↑+H2O(用离子方程式表示).
②IV中,操作步骤是蒸发浓缩、冷却结晶.
③装置B中盛放的试剂是(填化学式)NaOH溶液.
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
部分反应离子方程式为:
①Cr2O${\;}_{7}^{2-}$+6I-+14H+═2Cr3++3I2+7H2O;
②I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$.
Ⅰ.判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
Ⅱ.从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00 ml
Ⅲ.废水中Ba2+的物质的量浓度2.4×10-4mol•L-1.

(1)某研究小组设计了制备Na2S203•5H20装置和部分操作步骤如下.
I.打开K1关闭K2,向圆底 烧瓶中加入足量浓硫酸加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品Na2S203.5H20.
回答下列问题:
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因S2O32-+2H+═S↓+SO2↑+H2O(用离子方程式表示).
②IV中,操作步骤是蒸发浓缩、冷却结晶.
③装置B中盛放的试剂是(填化学式)NaOH溶液.
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O${\;}_{7}^{2-}$+6I-+14H+═2Cr3++3I2+7H2O;
②I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$.
Ⅰ.判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
Ⅱ.从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00 ml
Ⅲ.废水中Ba2+的物质的量浓度2.4×10-4mol•L-1.
17.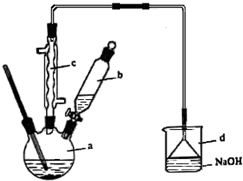 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,回答下列问题:
(1)c仪器的名称是球形冷凝管,向a中滴加几滴溴,有白雾产生,是因为生成了HBr气体,a中发生反应的化学方程式为 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是吸水(干燥).
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,应选择下列C操作(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)c仪器的名称是球形冷凝管,向a中滴加几滴溴,有白雾产生,是因为生成了HBr气体,a中发生反应的化学方程式为
 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的目的是吸水(干燥).
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,应选择下列C操作(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取.
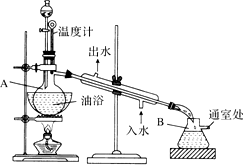 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.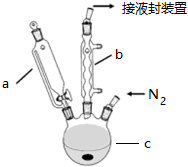
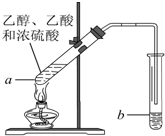 在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题: