题目内容
5.用化学用语填空:(1)5个磷酸根离子5 PO43-
(2)氯原子的结构示意图
 .
.
分析 (1)磷酸根是带有3个负电荷的阴离子,依据阴离子书写方法书写即可;
(2)氯是17号元素,有3个电子层,最外层电子数是7,据此解答即可.
解答 解:(1)磷酸根为带3个负电荷的阴离子,其中由4共热O原子和1个P原子构成,P元素显示正化合价,在前,O在后,5表示其个数,写在化学式前面,
故答案为:5 PO43-;
(2)氯是17号元素,有3个电子层,最外层电子数是7,原子结构示意图为: ,故答案为:
,故答案为: .
.
点评 本题主要考查的是化学用语的正确书写,掌握原子结构示意图以及离子的表示方法是关键,难度不大.

练习册系列答案
相关题目
16.H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.
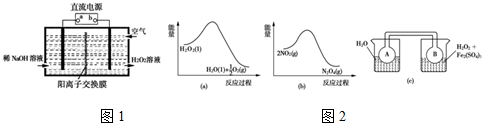
(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是正极.
②阴极电极反应式为O2+2e-+2H2O=H2O2+2OH-.
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该方法具有的优点是安全、能耗低.
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.

(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是正极.
②阴极电极反应式为O2+2e-+2H2O=H2O2+2OH-.
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该方法具有的优点是安全、能耗低.
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
20.在容积不变的密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,下列说法错误的是( )
| A. | NH3的质量分数将增加 | B. | 平衡向正反应方向移动 | ||
| C. | 平衡向逆反应方向移动 | D. | 正逆反应速率都增大 |
10.组成和结构可用 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )| A. | 16种 | B. | 18种 | C. | 20种 | D. | 22种 |
17.将少量金属钠投入下列稀溶液中,溶液质量减少的是( )
| A. | NaCl | B. | NaOH | C. | NH4NO3 | D. | Ca(HCO3)2 |
15.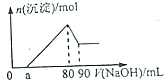 Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
 Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )| A. | 若a=20mL时,则混合物中Fe2O3占0.02mol | |
| B. | 所滴加的Na0H溶液的浓度为4mol/L | |
| C. | a点处,Na0H溶液的体积为a<50mL | |
| D. | 若a=20mL,则剩余盐酸的体积为20mL |
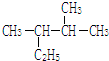 用系统命名法命名:2,3-二甲基戊烷;
用系统命名法命名:2,3-二甲基戊烷;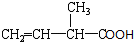 含氧官能团的名称是羧基;
含氧官能团的名称是羧基;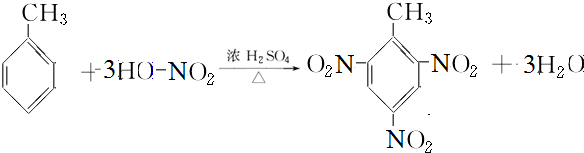 ;
; ;
;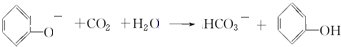 .
.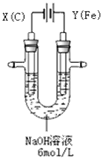 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.