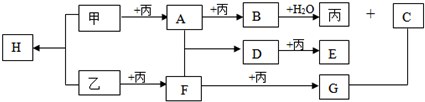
题目内容
16.H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.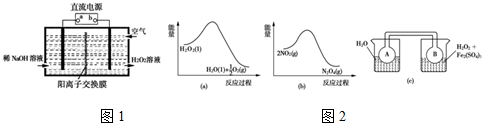
(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是正极.
②阴极电极反应式为O2+2e-+2H2O=H2O2+2OH-.
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该方法具有的优点是安全、能耗低.
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
分析 (1)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极;电解法需消耗电能,而催化法常温下即可进行;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动;
(3)溶液变成蓝色,铜被氧化成铜离子:Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O;当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
解答 解:(1)由题给信息氧气在阴极还原得到H2O2和稀碱的混合物,则b为负极,a为正极,阴极电极反应式为:O2+2e-+2H2O=H2O2+2OH-,电解需要消耗大量电能,而CO、O2和水在三苯膦钯的催化下室温制得了H2O2,不需要额外提供能量,故答案为:正极;O2+2e-+2H2O=H2O2+2OH-;能耗低;
(2)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深;H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动;
(3)铜与H2O2 和H2SO4 反应生成了硫酸铜,反应方程式是:Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O;由于温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小;
故答案为:Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O;温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
点评 本题综合考查原电池、电解池、化学平衡移动以及化学反应速率的影响等知识,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,本题注意把握化学基本理论知识,注意相关知识的积累,难度中等.

| A. | 反应每脱去1mol Cl2会生成1molSO42- | |
| B. | 脱氯反应后的溶液显酸性 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | 反应中硫元素发生了氧化反应 |
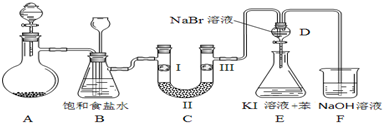
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗中液面上升,形成水柱.
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
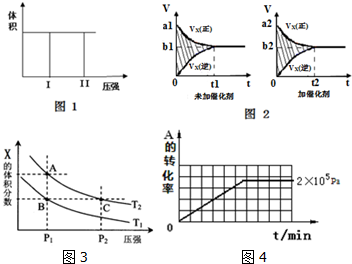
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H< 0; 熵变△S<0 ( 填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示.下列说法正确的是BD.
A. A、C两点的反应速率:A>C
B. A、C两点的气体密度:A<C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法
(Ⅱ)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是a+bmol.
(3)当压强为1×106 Pa时,此反应的平衡常数表达式:K=$\frac{c(C){\;}^{p}}{c(A){\;}^{m}}$.
(4)其他条件相同时,在上述三个压强下分别发生该反应.2×105 Pa时,A的转化率随时间变化如图4,请在图中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强).
| A. | 晶体硅与金刚石分子都是正四面体结构 | |
| B. | 硅酸盐都不溶于水? | |
| C. | 硅与酸、碱都不能发生反应 | |
| D. | 原硅酸和硅酸对应的酸酐都是二氧化硅 |

 .
.