题目内容
8.下列各组反应,前者是氧化还原反应,后者是非氧化原反应的是( )| A. | 实验室制取O2;实验室制取H2 | B. | 实验室制取CO2;CO2通入石灰水中 | ||
| C. | 实验室电解水;CaO溶于水 | D. | 氢、氧混合气体爆鸣;蜡烛燃烧 |
分析 反应中存在元素化合价的变化的反应属于氧化还原反应,据此分析.
解答 解:A.实验室制取O2,O元素化合价发生变化,属于氧化还原反应,实验室制取H2,H元素化合价发生变化,属于氧化还原反应,故A不选;
B.实验室制取CO2、CO2通入石灰水中,反应中没有元素化合价变化,不属于氧化还原反应,故B不选;
C.实验室电解水,O、H元素化合价发生变化,属于氧化还原反应,CaO溶于水,没有元素化合价变化,不属于氧化还原反应,故C选;
D.氢、氧混合气体爆鸣、蜡烛燃烧,存在元素化合价的变化,属于氧化还原反应,故D不选.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
19.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子 时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
20. 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=:-305.7 kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
①该反应是吸热反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
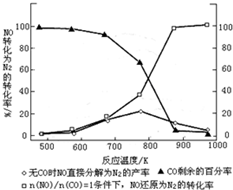
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2→CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1.
已知:H2O(l)=H2O(g)△H=+44kJ•mol-1 CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l)△H=:-305.7 kJ•mol-1.
(2)CH4和H2O(g)在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如下表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图.
①若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在$\frac{n(NO)}{n(CO)}$=1的条件下,应控制的最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出CH4与NO2发生反应的化学方程式CH4+2NO2→CO2+N2+2H2O.
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池负极的电极反应式为CH3CH2OH-12e-+6O2-=2CO2+3H2O.
18.下列有关含硅物质的说法正确的是( )
| A. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化碳通入水玻璃可以制得硅酸 | |
| D. | 水泥、玻璃、水晶饰物都是硅酸盐制品 |
