题目内容
16.(1)原电池是把化学能转化为电能的装置;正极发生还原反应;电子流出(流出或流入)的电极为负极(2)电解池和电源正极相连的电极为阳极,发生氧化反应,阳离子移向阴极.
分析 原电池是将化学能直接转换为电能的装置,负极是活泼金属失电子化合价升高的氧化反应,正极是电解质中的阳离子得到电子化合价降低的还原反应;电解时,与电源正极相连的为阳极,发生氧化反应,阳离子向阴极移动.
解答 解:(1)原电池是将化学能直接转换为电能的装置,正极发生还原反应,负极发生氧化反应,电子由负极经导线流向正极,故答案为:化学能;电能;还原;流出;
(2)电解时,与电源正极相连的为阳极,发生氧化反应,阳离子向阴极移动,故答案为:正极;氧化;阴.
点评 本题考查了原电池、电解池的原理,为高频考点,侧重于学生的分析能力,注意把握电子流向、电极判断,反应类型判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.除去NaNO3 溶液中混有的AgNO3,所用下列试剂中效果最好的是( )
| A. | NaCl 溶液 | B. | NaBr 溶液 | C. | NaI 溶液 | D. | Na2S 溶液 |
7.质量分数为W的NaOH溶液,其物质的量浓度为a,如加热蒸发水分使其质量分数变为2W,此时该溶液中NaOH的物质的量浓度为b,则a与b的关系正确的是( )
| A. | b>2a | B. | a=2b | C. | b=2a | D. | b<2a |
4.常温下,某溶液A中可能含有NH4+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行相关实验,实验结果如图所示,下列有关说法正确的是( )

| A. | 溶液中一定有SO42-,可能有Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
11.“84消毒液”,能有效杀灭甲型H7N9病毒,某同学参阅“84消毒液”,说明中的配方,欲用NaClO固体自己配制480mL含NaCl0 25%.密度为1.2g•cm -3的消毒液,下列说法正确的是( )
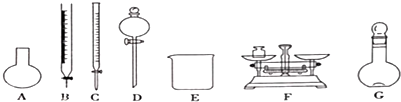

| A. | 需要称量NaClO固体的质量为144.0g | |
| B. | 定容摇匀后,若溶液液面低于容量瓶刻度线.不必再加水定容 | |
| C. | 除从如图所示的仪器中选择需要的以外.还-种玻填仪器 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制.否則结果偏低 |
1.下列说法正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 燃烧热是指可燃物热化学反应方程式中的△H | |
| C. | 用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 醋酸溶液的导电能力可能比稀硫酸强 |
8.下列各组反应,前者是氧化还原反应,后者是非氧化原反应的是( )
| A. | 实验室制取O2;实验室制取H2 | B. | 实验室制取CO2;CO2通入石灰水中 | ||
| C. | 实验室电解水;CaO溶于水 | D. | 氢、氧混合气体爆鸣;蜡烛燃烧 |
5.下列说法正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |