题目内容
17.工业上以乙苯为原料生产苯乙烯的反应如下(Ph代表苯基):Ph-CH2CH3(g)?Ph-CH═CH2(g)+H2(g)△H
某研究小组为探究温度等因素对该反应的产率影响,在容积可变的密闭容器中分别作了四组实验,实验结果如图a、b所示.

(1)根据反应及如图(a),判断H>0(填“<”“=”或“>”)K500℃>K400℃(填“<”“=”或“>”)
(2)下列事实可以说明该反应已达平衡的是AB.
A.混合气体的密度不再变化
B.氢气的体积分数保持不变
C.氢气、苯乙烯的生成速率之比保持不变
D.单位时间内消耗的n(乙苯)等于生成的n(H2)
(3)从压强因素分析,为提高乙苯的转化率,应采用低压的生产条件.实际工业生产中常采用通入水蒸气的方法.水蒸气的含量对反应的影响结果如图(b)所示.
①在做这四组实验时,应该采用的其他实验条件是AC.
A.反应温度相同 B.采用不同的催化剂
C.压强都控制在常压下 D.反应相同时间时测定实验数据
②由图b判断,随着$\frac{n({H}_{2}O)}{n(苯乙烯)}$比值增加产率增加的原因是正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
③若反应在保持其他条件不变的情况下,压缩体系的体积,在图c中做出改变条件后达到新的平衡,正逆反应速率的变化情况.
(4)若工业生产中既要提高化学反应速率,又要提高反应物的转化率,应采取的措施是升高温度.
分析 (1)由图可知,温度越高苯乙烯的产率越高,说明升高温度平衡正向移动,平衡常数增大,正反应为吸热反应;
(2)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(3)正反应为体积增大的可逆反应,减小压强,有利于平衡正向移动;
①①采取控制变量法分析,探究水蒸气的含量对反应的影响结果,应保持温度、压强、催化剂等体积相同,不涉及反应速率问题;
②保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
③压缩体积,压强增大,瞬间正逆速率都增大,平衡逆向移动,逆反应速率增大更多;
(4)升高温度、增大压强、增大浓度、使用催化剂等可以加快反应速率,要提高反应物的转化率,应是使平衡正向移动,但不能只增大乙苯的浓度,否则转化率降低.
解答 解:(1)由图可知,温度越高苯乙烯的产率越高,说明升高温度平衡正向移动,正反应为吸热反应,则△H>0,平衡常数K500℃>K400℃,
故答案为:>;>;
(2)A.混合气体总质量不变,恒温恒压下,随反应进行容器容积增大,混合气体的密度减小,当混合气体的不再变化时,反应到达平衡,故A正确;
B.可逆反应到达平衡时各组分的含量不变,氢气的体积分数保持不变,说明到达平衡,故B正确;
C.氢气、苯乙烯的生成速率之比等于其化学计量数之比,始终保持不变,故C错误;
D.单位时间内消耗的n(乙苯)等于生成的n(H2),均表示正反应速率,反应始终按该比例关系进行,故D错误,
故选:AB;
(3)正反应为体积增大的可逆反应,减小压强,平衡逆向移动,所以从压强因素分析,为提高乙苯的转化率,应采用低压的生产条件,故答案为:低压;
①探究水蒸气的含量对反应的影响结果,应保持温度、压强、催化剂等体积相同,不涉及反应速率问题,
故选:AC;
②正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率,
故答案为:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动;
③压缩体积,压强增大,瞬间正逆速率都增大,平衡逆向移动,逆反应速率增大更多,正逆反应速率的变化情况如图: ,
,
故答案为: ;
;
(4)正反应为气体体积增大的吸热反应,既要提高化学反应速率,又要提高反应物的转化率,应采取的措施是:升高温度等,
故答案为:升高温度.
点评 本题考查化学平衡影响因素、化学平衡状态判断、化学平衡图象等,综合考查学生阅读获取信息能力、应用知识分析解决问题能力,难度中等.

| A. | b>2a | B. | a=2b | C. | b=2a | D. | b<2a |
| A. | 实验室制取O2;实验室制取H2 | B. | 实验室制取CO2;CO2通入石灰水中 | ||
| C. | 实验室电解水;CaO溶于水 | D. | 氢、氧混合气体爆鸣;蜡烛燃烧 |
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
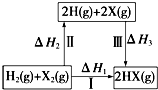
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | △H1=△H2+△H3 | |
| C. | 途径Ⅲ的按Cl、Br、I顺序依次增大 | |
| D. | 途径Ⅰ生成HCl比生成HBr的△H1小,说明HCl比HBr稳定 |
| A. | Cu Al2O3 NaHCO3 | B. | Mg Al(OH)3 Na2CO3 | ||
| C. | Fe Al2O3,Al(OH)3 | D. | Al NaHCO3 Al2O3 |
 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯. (g)→
(g)→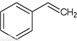 (g)+H2(g),△H=+117.6kJ/mol;①②的化学反应平衡常数分别为K1、K2,
(g)+H2(g),△H=+117.6kJ/mol;①②的化学反应平衡常数分别为K1、K2, (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol该反应的化学平衡常数K=K1•K2(用K1、K2表示)
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol该反应的化学平衡常数K=K1•K2(用K1、K2表示)