题目内容
A、B、C、D、E、F为原子序数依次增大的主族元素.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3.回答:
(1)写出下列元素的符号:A 、D 、E ;
(2)写出A、F形成的化合物的电子式 ;
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为 ;
(4)A、F两种元素最高价氧化物的水化物反应的化学方程式为 ;
(5)比较D、E最高价氧化物的水化物的酸性: (填化学式).
(1)写出下列元素的符号:A
(2)写出A、F形成的化合物的电子式
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为
(4)A、F两种元素最高价氧化物的水化物反应的化学方程式为
(5)比较D、E最高价氧化物的水化物的酸性:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F为原子序数依次增大的主族元素,D元素的最外层电子数比次外层电子数少4,则D元素原子最外层电子数为4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则E为P元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,以此来解答.
解答:
解:A、B、C、D、E、F为原子序数依次增大的主族元素,D元素的最外层电子数比次外层电子数少4,则D元素原子最外层电子数为4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,则最外层电子数为8-3=5,则E为P元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,综上所述,A为Na、B为Mg、C为Al,D为Si、E为P,F为Cl,
(1)由上述分析可知,A为Na、D为Si,E为P,故答案为:Na;Si;P;
(2)A、F形成的化合物为NaCl,为离子化合物,其电子式为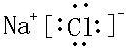 ,故答案为:
,故答案为: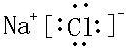 ;
;
(3)A为Na,其最高价氧化物的水化物为NaOH,C为Al,其最高价氧化物的水化物为氢氧化铝,它们之间反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)A、F两种元素最高价氧化物的水化物反应的化学方程式为HClO4+NaOH=NaClO4+H2O,故答案为:HClO4+NaOH=NaClO4+H2O;
(5)非金属性P>Si,则D、E最高价氧化物的水化物的酸性为H3PO4>H2SiO3,故答案为:H3PO4>H2SiO3.
(1)由上述分析可知,A为Na、D为Si,E为P,故答案为:Na;Si;P;
(2)A、F形成的化合物为NaCl,为离子化合物,其电子式为
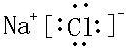 ,故答案为:
,故答案为: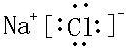 ;
;(3)A为Na,其最高价氧化物的水化物为NaOH,C为Al,其最高价氧化物的水化物为氢氧化铝,它们之间反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)A、F两种元素最高价氧化物的水化物反应的化学方程式为HClO4+NaOH=NaClO4+H2O,故答案为:HClO4+NaOH=NaClO4+H2O;
(5)非金属性P>Si,则D、E最高价氧化物的水化物的酸性为H3PO4>H2SiO3,故答案为:H3PO4>H2SiO3.
点评:本题考查结构性质位置关系,为高频考点,涉及常用化学用语、元素周期律等,把握原子结构及元素化合物性质推断元素是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
下列电离方程式错误的是( )
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、KClO3=K++Cl-+3O2- |
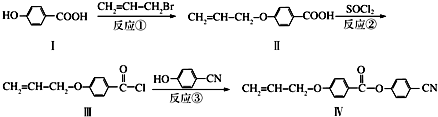
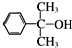 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是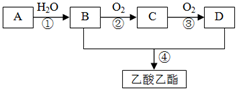 已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题:
已知:A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.回答下列问题: 为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案:
为测定放置一段时间的小苏打样品中纯碱的质量分数,某化学兴趣小组设计如下实验方案: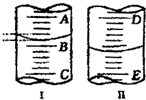 (1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是
(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是