题目内容
下列电离方程式错误的是( )
| A、Na2CO3=2Na++CO32- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHCO3=Na++HCO3- |
| D、KClO3=K++Cl-+3O2- |
考点:电离方程式的书写
专题:
分析:强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,书写时要遵循原子守恒、电荷守恒,据此分析解答.
解答:
解:A.碳酸钠为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故A正确;
B.硫酸氢钠为强电解质,完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故B正确;
C.碳酸氢钠为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-,故C正确;
D.氯酸根离子为原子团不能拆,电离方程式为:KClO3=K++ClO3-,故D错误;
故选:D.
B.硫酸氢钠为强电解质,完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故B正确;
C.碳酸氢钠为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-,故C正确;
D.氯酸根离子为原子团不能拆,电离方程式为:KClO3=K++ClO3-,故D错误;
故选:D.
点评:本题考查了电离方程式的书写,明确电解质的强弱、电离方程式的书写方法是解题关键,题目难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列物质的用途与其化学性质相关的是( )
| A、用氮气作食品包装袋的填充气 |
| B、用金刚石切割玻璃 |
| C、用活性炭作净水剂 |
| D、用金属铝作导线 |
可把苯酚、硫氰化钾、乙醇、氢氧化钠、硝酸银等五种溶液鉴别出来的试剂是( )
| A、浓溴水 |
| B、酚酞溶液 |
| C、NaBr溶液 |
| D、FeCl3溶液 |
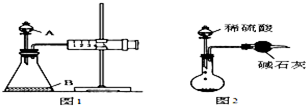 学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案:
学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案: