题目内容
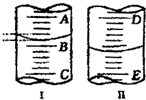 (1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是
(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是(2)图Ⅱ表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)
A.是a mL B.是(25-a)mL C.一定大于a mL D.一定大于(25-a)mL
(3)写出下列物质的水解离子方程式
NaClO溶液:
考点:计量仪器及使用方法,盐类水解的应用
专题:
分析:(1)根据量筒的构造及图示凹液面所在的刻度读出溶液体积;
(2)液面处的读数是aml,则有读数部分的液体体积为(25-a)mL,滴定管下端有一定没有刻度,滴定管内液体的体积大于(25-a)mL;
(3)NaClO为强碱弱酸盐,水解呈碱性;Fe2(SO4)3为强酸弱碱盐,铁离子在水溶液中结合氢氧根;离子生成氢氧化铁.
(2)液面处的读数是aml,则有读数部分的液体体积为(25-a)mL,滴定管下端有一定没有刻度,滴定管内液体的体积大于(25-a)mL;
(3)NaClO为强碱弱酸盐,水解呈碱性;Fe2(SO4)3为强酸弱碱盐,铁离子在水溶液中结合氢氧根;离子生成氢氧化铁.
解答:
解:(1)读数时,应取凹液面的最低点,因A与B,B与C刻度间相差1mL,则每一小格为0.2 mL,又A为5,则B为4,故图2读数为4.2mL,故答案为:4.2;
(2)液面处的读数是aml,则有读数部分的液体体积为(25-a)mL,滴定管下端有一定没有刻度,滴定管内液体的体积大于(25-a)mL,
故答案为:D;
(3)NaClO为强碱弱酸盐,水解呈碱性,离子方程式为 ClO-+H2O?HClO+OH-;Fe2(SO4)3为强酸弱碱盐,铁离子在水溶液中结合氢氧根;离子生成氢氧化铁,溶液呈酸性,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,故答案为:ClO-+H2O?HClO+OH-;Fe3++3H2O?Fe(OH)3+3H+.
(2)液面处的读数是aml,则有读数部分的液体体积为(25-a)mL,滴定管下端有一定没有刻度,滴定管内液体的体积大于(25-a)mL,
故答案为:D;
(3)NaClO为强碱弱酸盐,水解呈碱性,离子方程式为 ClO-+H2O?HClO+OH-;Fe2(SO4)3为强酸弱碱盐,铁离子在水溶液中结合氢氧根;离子生成氢氧化铁,溶液呈酸性,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,故答案为:ClO-+H2O?HClO+OH-;Fe3++3H2O?Fe(OH)3+3H+.
点评:本题考查常见仪器的使用,盐类水解的实质、规律、反应离子方程式书写,为高频考点,题目着重于双基知识的考查,注意把握水解规律和原理,题目较简单.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
可把苯酚、硫氰化钾、乙醇、氢氧化钠、硝酸银等五种溶液鉴别出来的试剂是( )
| A、浓溴水 |
| B、酚酞溶液 |
| C、NaBr溶液 |
| D、FeCl3溶液 |
利用CCl4将碘水中的碘萃取出来,其原理是碘在 中溶解性比在 中的大,可将碘从水中萃取出来.现用10CCl4和15mL碘水在 中混合,充分震荡,精致分层,下层显 色,打开活塞分液,烧杯中接受到的是 .
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的
(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
| 8 |
| 9 |
| A、3:4:1 |
| B、3:3:2 |
| C、6:7:3 |
| D、6:9:1 |
 ;(D)
;(D)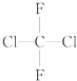 和
和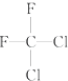 ;(E)甲烷和新戊烷.
;(E)甲烷和新戊烷.