题目内容
已知:Fe(s)+
O2(g)═FeO(s)△H1=-272kJ/mol,2Al(s)+
O2(g)═Al2O3(s)△H2=-1 675kJ/mol,则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
| 1 |
| 2 |
| 3 |
| 2 |
| A、859 kJ/mol |
| B、-859 kJ/mol |
| C、-1403 kJ/mol |
| D、-2491 kJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:依据题干热化学方程式结合盖斯定律写出该热化学反应方程式,反应热进行相应的改变,求解△H.
解答:
解:①Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1
②2Al(s)+
O2(g)=Al2O3(s)△H=-1675kJ?mol-1
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=[-1675kJ?mol-1-(-272.0kJ?mol-1)×3]=-859kJ?mol-1,
故选B.
| 1 |
| 2 |
②2Al(s)+
| 1 |
| 2 |
将方程式②-①×3得2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=[-1675kJ?mol-1-(-272.0kJ?mol-1)×3]=-859kJ?mol-1,
故选B.
点评:本题考查了盖斯定律,根据题给方程式进行整合得出目标方程式,反应热进行相应的改变,难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A、c(HCOO-)>c(Na+) |
| B、c(HCOO-)<c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、无法确定c(HCOO-)与c(Na+)的关系 |
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是( )
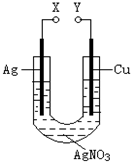

| A、X和Y不连接时,铜棒上会有金属银析出 |
| B、X和Y用导线连接时,银棒是正极,发生氧化反应 |
| C、若X接直流电源的正极,Y接负极,Ag+向铜电极移动 |
| D、无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
下列金属中,一定条件下既能跟Cl2反应,又能跟稀盐酸反应,且均生成MCl2型化合物的是( )
| A、Al | B、Fe | C、Cu | D、Mg |
在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,生成2体积气体化合物Z,则Z的化学式可能是( )
| A、X2Y3 |
| B、XY |
| C、X2Y |
| D、XY3 |
分类是化学学习与研究的常用方法,下列分类正确的是( )
| A、Na2O2、MgO、Al2O3均属于碱性氧化物 |
| B、纯碱、烧碱、熟石灰均属于碱 |
| C、酸、碱、盐之间发生的反应均属于复分解反应 |
D、 混合物、分散系、胶体从属关系如图所示 混合物、分散系、胶体从属关系如图所示 |
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: