题目内容
露置于空气中一段时间后的水玻璃会浑浊.向此浑浊溶液中加入稀盐酸,会生成白色胶状沉淀,同时伴随有气泡产生.用化学方程式解释产生上述现象的原因:
(1)溶液变浑浊: ,说明硅酸的酸性比碳酸 .(填“强”或“弱”)
(2)生成白色胶状沉淀: ;
(3)产生气泡: .
(1)溶液变浑浊:
(2)生成白色胶状沉淀:
(3)产生气泡:
考点:含硅矿物及材料的应用
专题:碳族元素
分析:(1)水玻璃是硅酸钠的水溶液,碳酸的酸性强于硅酸,所以水玻璃能与空气中二氧化碳反应生成硅酸沉淀;
(2)盐酸是强酸,硅酸是弱酸,水玻璃是强碱弱酸盐,所以盐酸能和硅酸钠反应生成硅酸沉淀;
(3)露置于空气中一段时间后的水玻璃和空气中的二氧化碳反应生成硅酸沉淀的同时生成碳酸钠,碳酸钠和盐酸反应有二氧化碳生成;
(2)盐酸是强酸,硅酸是弱酸,水玻璃是强碱弱酸盐,所以盐酸能和硅酸钠反应生成硅酸沉淀;
(3)露置于空气中一段时间后的水玻璃和空气中的二氧化碳反应生成硅酸沉淀的同时生成碳酸钠,碳酸钠和盐酸反应有二氧化碳生成;
解答:
解:(1)空气中有二氧化碳,二氧化碳和水反应生成碳酸,碳酸的酸性强于硅酸,根据强酸制弱酸,水玻璃能与空气中二氧化碳反应生成硅酸沉淀,
反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,由于是强酸制弱酸,故说明硅酸的酸性比碳酸弱,
故答案为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;弱;
(2)置于空气中一段时间后的水玻璃会浑浊,但此时出现的硅酸沉淀的量较少,向此浑浊溶液中加入稀盐酸,盐酸是强酸,硅酸是弱酸,所以盐酸能和浑浊溶液中的硅酸钠反应生成硅酸沉淀,反应为:Na2SiO3+2HCl=H2SiO3↓+2NaCl,
故答案为:Na2SiO3+2HCl=H2SiO3↓+2NaCl;
(3)因盐酸的酸性强于碳酸,碳酸的酸性强于硅酸,所以露置于空气中一段时间后的水玻璃和空气中的二氧化碳反应生成硅酸沉淀的同时生成碳酸钠,当向该混合物中滴加盐酸,盐酸先和剩余的硅酸钠反应,假设先和碳酸钠反应,那反应生成的二氧化碳还是和硅酸钠反应生成硅酸和碳酸钠,所以假设不成立,应为当向此浑浊溶液中滴加盐酸,先发生Na2SiO3+2HCl=H2SiO3↓+2NaCl,后发生Na2CO3+2HCl=2NaCl+CO2↑+H2O,
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
反应为Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,由于是强酸制弱酸,故说明硅酸的酸性比碳酸弱,
故答案为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;弱;
(2)置于空气中一段时间后的水玻璃会浑浊,但此时出现的硅酸沉淀的量较少,向此浑浊溶液中加入稀盐酸,盐酸是强酸,硅酸是弱酸,所以盐酸能和浑浊溶液中的硅酸钠反应生成硅酸沉淀,反应为:Na2SiO3+2HCl=H2SiO3↓+2NaCl,
故答案为:Na2SiO3+2HCl=H2SiO3↓+2NaCl;
(3)因盐酸的酸性强于碳酸,碳酸的酸性强于硅酸,所以露置于空气中一段时间后的水玻璃和空气中的二氧化碳反应生成硅酸沉淀的同时生成碳酸钠,当向该混合物中滴加盐酸,盐酸先和剩余的硅酸钠反应,假设先和碳酸钠反应,那反应生成的二氧化碳还是和硅酸钠反应生成硅酸和碳酸钠,所以假设不成立,应为当向此浑浊溶液中滴加盐酸,先发生Na2SiO3+2HCl=H2SiO3↓+2NaCl,后发生Na2CO3+2HCl=2NaCl+CO2↑+H2O,
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
点评:本题主要考查了硅酸的制取,明确盐酸的酸性强于碳酸,碳酸的酸性强于硅酸是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
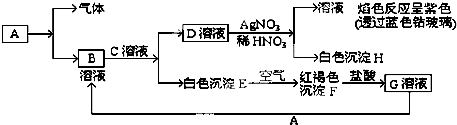
(1)试回答:写出B的化学式 C的化学式 H的化学式
(2)写出由E转变成F的化学方程式 .
(3)向G溶液加入A的有关离子反应方程式 .

(1)试回答:写出B的化学式
(2)写出由E转变成F的化学方程式
(3)向G溶液加入A的有关离子反应方程式
某同学利用苹果可以制作水果原电池,如图所示.下列说法正确的是( )


| A、电流计指针偏转时,说明发生了氧化还原反应 |
| B、苹果汁中无电解质 |
| C、两个电极的材料可以相同 |
| D、水果电池工作时氧化反应和还原反应在同一处进行 |
一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②CO③CO和H2的混合物 ④HCOOCH3 ⑤CH3CHO.
①H2 ②CO③CO和H2的混合物 ④HCOOCH3 ⑤CH3CHO.
| A、⑤ | B、①② |
| C、①②③④ | D、①②③④⑤ |
根据对角线原则,Be和Al的化学性质相似,下列说法正确是( )
| A、BeCl2溶液 pH>7,将其蒸干,灼烧后可得到BeCl2晶体 |
| B、BeCl2溶液能导电,说明BeCl2一定是离子化合物 |
| C、Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 |
| D、Be只能与盐酸反应,不能与NaOH溶液反应 |
已知:Fe(s)+
O2(g)═FeO(s)△H1=-272kJ/mol,2Al(s)+
O2(g)═Al2O3(s)△H2=-1 675kJ/mol,则2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)的△H是( )
| 1 |
| 2 |
| 3 |
| 2 |
| A、859 kJ/mol |
| B、-859 kJ/mol |
| C、-1403 kJ/mol |
| D、-2491 kJ/mol |
将28克铁粉溶于500mL的某稀硝酸溶液中,二者刚好完全反应,已知还原产物只有NO,且反应后的溶液比反应前增加了16克,则原硝酸浓度是( )mol/L.
| A、6.4 | B、4.8 |
| C、3.2 | D、2.4 |
下列关于氢氧化铁胶体的叙述,正确的是( )
| A、往氢氧化铁胶体中逐滴加入稀盐酸先出现沉淀后沉淀溶解 |
| B、在含2 mol的氢氧化铁的胶体中含有氢氧化铁胶粒数为2NA |
| C、滤纸可将氢氧化铁胶体中的分散质与分散剂分离 |
| D、氢氧化铁胶体带正电荷 |
 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: