题目内容
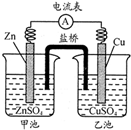 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置是原电池,锌易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为Cu2++2e-=Cu,原电池放电时,盐桥中阳离子向正极区域移动、阴离子向负极区域移动.
解答:
解:A.该原电池中,Zn易失电子作负极,电极反应式为Zn-2e-=Zn2+,故A错误;
B.原电池放电时,盐桥中阳离子向正极区域移动、阴离子向负极区域移动,所以盐桥不变蓝色,故B错误;
C.向乙池中通入H2S后,发生反应H2S+Cu2+=CuS↓+2H+,溶液变为硫酸溶液,Cu电极上氢离子放电,故C错误;
D.若将电极Cu改为石墨,石墨的导电性不如Cu号,所以电池电流强度发生变化,故D正确;
故选D.
B.原电池放电时,盐桥中阳离子向正极区域移动、阴离子向负极区域移动,所以盐桥不变蓝色,故B错误;
C.向乙池中通入H2S后,发生反应H2S+Cu2+=CuS↓+2H+,溶液变为硫酸溶液,Cu电极上氢离子放电,故C错误;
D.若将电极Cu改为石墨,石墨的导电性不如Cu号,所以电池电流强度发生变化,故D正确;
故选D.
点评:本题考查了原电池原理,明确正负极上发生的反应、盐桥中离子移动方向是解本题关键,易错选项是C,注意通入硫化氢后溶液变化,题目难度中等.

练习册系列答案
相关题目
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
下列说法正确的是( )
| A、煤的干馏、石油的分馏都是物理变化 |
| B、工业上常用澄清石灰水和氯气反应制漂白粉 |
| C、蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D、二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表.下列说法正确的是( )
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |
警察常从案发现场的人体气味来获取有用的线索,人体气味的成分中含有多种有机物,比如:
①十八烷
②环十二醇,
关于这二种有机物,下列说法不正确的是( )
①十八烷
②环十二醇,
关于这二种有机物,下列说法不正确的是( )
| A、①和②分子中碳原子数大于10 |
| B、①和②常温常压下不为气态 |
| C、①和②均能与Na反应放出氢气 |
| D、②的分子式为C12H24O |